
【题目】某温度时,在容积为3 L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
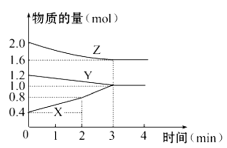
(1)该反应的化学方程式为____________ _______。
(2)反应开始至2 min末,X的反应速率为_____ ____。
(3)该反应是由__________(填序号)开始的。
①正反应 ②逆反应 ③正、逆反应同时
(4)若增加Y的用量,化学反应速率不变化,则Y为__ ___态。
【答案】
(1)Y+2Z![]() 3X
3X
(2)0.067mol/(L.min)
(3)③
(4)固或纯液
【解析】
试题分析:(1)根据图知,随着反应进行,X的物质的量增大、Y和Z的物质的量减少,则X是生成物、Y和Z是反应物,达到平衡状态时,△n(X)=(1.0-0.4)mol=0.6mol、△n(Y)=(1.2-1.0)mol=0.2mol、△n(Z)=(2.0-1.6)mol=0.4mol,同一反应中同一时间段内各物质的计量数之比等于物质的量变化量之比,所以Y、Z、X的计量数之比=0.2mol:0.4mol:0.6mol=1:2:3,反应方程式为Y+2Z3X。
故答案为:Y+2Z3X;
(2)反应开始至2min末,X的反应速率=![]() =
= =0.067mol/(L·min)。
=0.067mol/(L·min)。
故答案为:0.067mol/(L·min);
(3)根据图知,反应开始时反应物和生成物都有,所以开始时正逆反应同时进行。
故答案为:③;
(4)若增加Y的用量,化学反应速率不变化,说明Y不存在浓度而言,所以Y为固态或纯液态。
故答案为:固或纯液。


科目:高中化学 来源: 题型:
【题目】下列推断正确的是
A. SiO2是酸性氧化物,能与NaOH溶液反应
B. Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C. CO2, SO2排放到空气中都能形成酸雨,应严格控制排放
D. 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
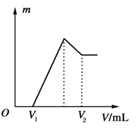
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_____ (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ ,反应的离子方程式为____ __。
(3)实验室溶解该熔融物,下列试剂中最好的是___ ___(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
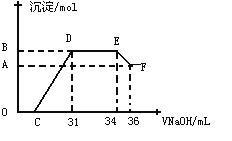
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为______。
(5)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ,上述现象说明溶液中____结合OH—的能力比______强(填离子符号)。
(6)B点对应的沉淀的物质的量为____ __mol,C点对应的氢氧化钠溶液的体积为____ __mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HA、H2B是两种弱酸,H2B+A-=HB-+HA, B2-+HA=HB-+A-则下列说法正确的是 ( )
A.H2B的电离方程式为:H2B![]() 2H+ + B2-
2H+ + B2-
B.结合质子能力由强到弱的顺序为:B2->A->HB-
C.等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强
D.等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
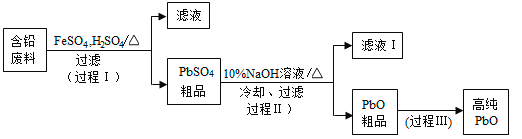
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
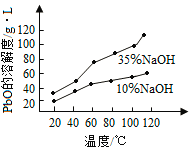
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_____(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.2-甲基丙烷也称异丁烷
B.蔗糖和纤维素都属于高分子化合物
C.苯使溴水褪色是因为发生了取代反应
D.C3H6O2有3种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的命名正确的是
A.CH3CH2CH(CH3)CH(CH3)OH :3-甲基-2-戊醇
B.CH3CH(CH3)CH=CH2:3-甲基丁烯
C.CH3CH2C(CH3)2CH3:2,2-甲基丁烷
D.CH2Cl-CH2Cl:二氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义,下列是回收金属铜和刻蚀液再生的流程图,回答下列问题:
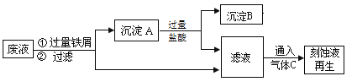
(1)沉淀A中含有的单质是 。
(2)通入的气体C的化学式是 。
(3)滤液与气体C反应生成刻蚀液的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com