
(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目
(2)2.8gCO的物质的量为 mol,含有 个原子,完全与氧化铜反应时失去电子 mol。
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 元素 | 原子结构或性质 | ||
| A | 原子最外层电子数是内层电子总数的
| ||
| B | 形成化合物种类最多的元素,其单质为固体 | ||
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 | ||
| D | 地壳中含量最多的元素 | ||
| E | 与D同主族 | ||
| F | 与E同周期,且最外层电子数等于电子层数 |


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:038
硝酸工业产生的尾气(NO、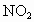 等)对环境造成污染,同时汽车尾气(含烃类、CO、
等)对环境造成污染,同时汽车尾气(含烃类、CO、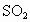 与NO等)是城市空气的污染源.
与NO等)是城市空气的污染源.
(1)汽车以汽油作为发动机燃料,在不断启动打火的过程中产生了CO、NO等有毒气体,若供氧不足.主要产生的污染物是__________________,若供氧充足,主要产生的有毒气体是_____________________________.
(2)简述CO、NO对人体产生的影响是_____________________________.
(3)谈一谈汽车尾气污染物对环境造成的影响_______________________.
(4)汽车尾气治理方法之一是在汽车的排气管上装一个“催化转化器”(用铂、钯合金作催化剂).它可以使CO与NO反应,生成可参与大气环境循环的无毒气体.
①写出CO与NO反应的化学方程式______________________________.
②“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是_____________________________________________________________.
(5)你能否应用氮元素的单质和化合物之间的转化关系,设计除去汽车尾气中氮的氧化物(NO、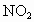 )的理论方案?
)的理论方案?
(6)控制城市空气污染的方法可以有
[ ]
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省玉溪一中高二上学期期末考试化学试卷(带解析) 题型:填空题
(每空2分,共6分)热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________。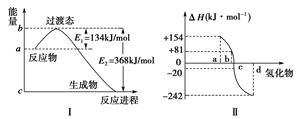
(2)图Ⅱ表示氧族元素中的氧、硫、硒、碲在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_________________________________________________。
(3)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);
ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);
ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);
ΔH=19 kJ·mol-1
请写出CO还原FeO的热化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届云南省高二上学期期末考试化学试卷(解析版) 题型:填空题
(每空2分,共6分)热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________。
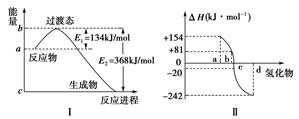
(2)图Ⅱ表示氧族元素中的氧、硫、硒、碲在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_________________________________________________。
(3)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);
ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);
ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);
ΔH=19 kJ·mol-1
请写出CO还原FeO的热化学方程式:
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com