
(16分)I.合成氨的原料气H2可通过反应CO(g)+H2O(g)  CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(2)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为 4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
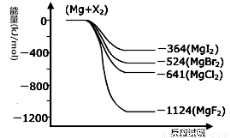
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
(16分)
I.(1) 60 %(2分) 2.25(2分)
(2) c、d(2分)
II.(1)
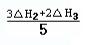 (2分)
(2分)
(2)①O2 + 4e-+ 2H2O  4OH- (2分) ② 2.24 (2分)
4OH- (2分) ② 2.24 (2分)
III.(1)放热 (2分)
(2)2CH3MgCl+H2O=2CH4↑+Mg(OH)2↓+MgCl2或CH3MgCl+H2O=CH4↑+Mg(OH)Cl↓(2分)
【解析】
试题分析:I.(1)设平衡时CO的浓度减少xmol/L,则
CO(g)+H2O(g)  CO2 (g) +H2(g)
CO2 (g) +H2(g)
开始(mol/L)1/5=0.2 1/5=0.2
转化(mol/L)x x x x
平衡(mol/L)0.2-x 0.2-x x x
根据题意,CO的浓度为0.08 mol·L-1,则0.2-x=0.08,x=0.12,所以CO的转化率是0.12/0.2×100%=60%;
平衡常数K= c(CO2)·c(H2)/c(CO)·c(H2O)=x2/(0.2-x)2=2.25;
(2)a.因为该反应是气体的物质的量不变的可逆反应,则容器内压强始终不随时间改变,不能判断平衡状态,错误;b.因为容器的体积不变,则混合气体的密度始终不随时间改变,不能判断平衡状态,错误; c.单位时间内生成a mol CO2的同时消耗a mol H2,符合正逆反应速率相等,是平衡状态,正确;d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6时,Qc= c(CO2)·c(H2)/c(CO)·c(H2O)= 6×6/1×16=2.25=K,所以是平衡状态,答案选cd;
II.(1)①中无NO气体,根据盖斯定律,将②×3+③×2 消去NO可得5×①,所以①中的△H1=(3△H2+2△H3)/5;
(2)①根据4NH3+3O2=2N2+6H2O,可知正极是氧气发生还原反应,生成氢氧根离子,所以正极的电极反应式为O2 + 4e-+ 2H2O  4OH-;
4OH-;
②9.75gZn的物质的量是9.75g/65g/mol=0.15mol,则失去电子的物质的量是0.15mol×2=0.30mol,根据得失电子守恒,则氧气得到电子的物质的量是0.30mol,则需要氧气的体积是0.30mol/4×22.4L/mol=1.68L,所以氨气的体积是1.68L×4/3=2.24L.
III.(1)由图可知,反应物的总能量大于生成物的总能量,所以反应为放热反应;
(2)CH3MgCl易与水发生水解反应并有无色无味气体和沉淀生成,该沉淀为氢氧化镁沉淀,根据元素守恒,则该气体中含C元素,为甲烷气体,同时还有氯化镁生成,则反应的化学方程式为2CH3MgCl+H2O=2CH4↑+Mg(OH)2↓+MgCl2。
考点:考查化学平衡的判断、计算,电化学反应原理的应用,化学方程式的判断与书写


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
向一定量的Cu、Fe2O3的混合物中加人600mL 2mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,再加入过量1 mol/L NaOH溶液,将沉淀过滤、洗涤、干燥,称得质量比原混合物增重17.6g,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量是
A.4.8 g B.8.8 g C.9.6g D.14.4g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
下列所陈述的事实与解释均正确的是
选项 | 事实 | 解释 |
A | 用pH试纸测出新制氯水的pH为3 | 新制氯水有酸性 |
B | C2H5OH与浓硫酸共热170℃,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
C | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
A.Y的气态简单氢化物的热稳定性比W的强
B.X的最高价氧化物对应水化物的酸性比W的弱
C.Y分别与Z、W形成的化合物均为碱性氧化物
D.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省英文学校高三上学期12月月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说正确的是
A、高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B、室温下,1L pH=13的NaOH溶液中,由水电离的OH- 离子数目为0.1NA
C、氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D、5NH4NO3 = 2HNO3 + 4N2↑ + 9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合试卷(解析版) 题型:选择题
下列有关说法正确的是
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液可制备Fe(OH)3胶体
C.等体积pH=12的氨水和pH=12的NaOH溶液可中和含等物质的量HCl的盐酸
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用酸去除
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期12月月考化学试卷(解析版) 题型:填空题
(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3— + 4H+ + 3e- NO↑+2H2O; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
NO↑+2H2O; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)反应中硝酸体现了 等化学性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是 mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期12月月考化学试卷(解析版) 题型:选择题
以下离子方程式正确的是
A.氧化铁溶于氢碘酸:Fe2O3 + 6H+ = 2Fe3+ + 3H2O
B.等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+ Ba2+ + OH- = BaCO3↓+ H2O
C.NaHSO3溶液显酸性是因为:HSO3- = SO32- + H+
D.硫化钠水溶液呈碱性的原因:S2 - + 2H2O  H2S + 2OH-
H2S + 2OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一12月月考化学试卷(解析版) 题型:选择题
下面关于金属钠的描述正确的是
A.钠的化学性质很活泼,钠离子和钠原子都具有较强的还原性
B.钠能把钛锆等金属从它们的盐溶液中还原出来
C.钠与氧气反应的产物与反应条件有关
D.钠和钾的合金在室温下呈固态,可作原子反应堆的导热剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com