
分析 NH3•H2O是弱电解质,在溶液中部分电离,PH=13的NH3•H2O中NH3•H2O的浓度大于0.1mol/L,PH=1的盐酸中HCl的浓度为0.1mol/L,等体积混合后溶液中溶质为氯化铵和氨水,结合溶液的酸碱性分析.
解答 解:NH3•H2O是弱电解质,在溶液中部分电离,PH=13的NH3•H2O中NH3•H2O的浓度大于0.1mol/L,PH=1的盐酸中HCl的浓度为0.1mol/L,等体积混合后溶液中溶质为氯化铵和氨水,溶液显碱性,氨水的电离程度大于铵根离子的水解程度,所以离子浓度大小顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查了离子浓度大小比较,根据溶液中的溶质及溶液酸碱性结合守恒思想分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
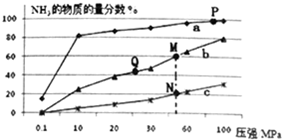 已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.
已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:H+、Al3+、NO3-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适当升高温度 | |
| B. | 将锌粒改为锌粉 | |
| C. | 将所用硫酸改为98%左右的硫酸溶液 | |
| D. | 寻找一种合适的催化剂并加入其中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素 | |
| B. | 原子序数为48的元素 | |
| C. | 原子核外L层比M层多一个电子的元素 | |
| D. | 原子核外M层有8个电子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
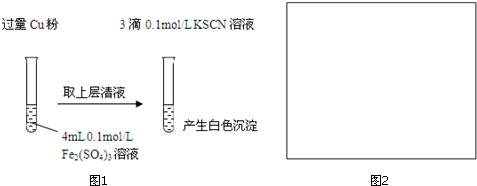
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| :步骤2:取取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X难溶于乙醇 | |
| B. | 酒中的少量丁酸能抑制X的水解 | |
| C. | 分子式为C4H8O2且官能团与X相同的物质共有5种 | |
| D. | X完全燃烧后生成CO2和H20的物质的量比为1:2. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com