

分析 (1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理书写其基态核外电子排布式;
②根据价层电子对互斥理论确定空间构型;
(2)A.根据价层电子对互斥理论确定杂化方式;
B.同一主族元素的氢化物中,含有氢键的氢化物沸点较高;
C.提供孤电子对的原子是配位原子;
D.CN-的结构和氮气分子相似,根据氮气分子的电子式判断;
(3)①根据相似相溶原理确定分子的极性;
②利用均摊法计算;
(4)根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中含有Ni、H2的个数关系来解答;
(5)先根据均摊法确定该晶胞中含有的各种原子个数,从而得出其质量,再根据V=$\frac{m}{ρ}$计算其体积;
解答 解:(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为:1s22s22p63s23p63d2;
故答案为:1s22s22p63s23p63d2;
②BH4-中B原子价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,且没有孤电子对,所以是正四面体结构;
故答案为:正四面体;
(2)A.NH3分子中N原子含有3个共用电子对和一个孤电子对,所以其价层电子对为4,采用sp3杂化,故A正确;
B.相同压强时,氨气中含有氢键,PH3中不含氢键,所以NH3沸点比PH3高,故B正确;
C.[Cu(NH3)4]2+离子中,N原子提供孤电子对,所以N原子是配位原子,故C正确;
D.CN-与氮气互为等电子体,结构与氮气相同,据此可以判断CN-的电子式为: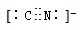 ,故D正确;
,故D正确;
故选:ABCD;
(3)①苯、CS2都是非极性分子,根据相似相溶原理知,C60是非极性分子;
故答案为:非极性;
②利用均摊法知,每个碳原子含有$\frac{1}{2}$×3=$\frac{3}{2}$个σ 键,所以1mol C60分子中,含有σ 键数目=$\frac{3}{2}$×1mol×60×NA/mol=90NA;
故答案为:90NA;
(4)根据镍基合金储氢后的晶胞结构图,利用均摊法,可知每个晶胞中Ni原子位于面心和体心,数目为1+8×$\frac{1}{2}$=5,H2分子位于面心和棱上,数目为2×$\frac{1}{2}$+8×$\frac{1}{4}$=3,所以当含0.5molNi的合金可吸附氢气可吸附H2的数目为0.3mol,体积为6.72L;
故答案为:6.72L;
(5)该晶胞中镁原子个数=$\frac{1}{8}$×8+1=2,氢原子个数=4×$\frac{1}{2}$+2=4,ρ=$\frac{m}{V}$=$\frac{\frac{(24×2+1×4)}{NA}}{ag•cm-3}$=$\frac{52}{a•NA}$;
故答案为:$\frac{52}{a•NA}$.
点评 本题考查物质结构和性质,涉及核外电子排布、杂化方式的判断、空间构型的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 高锰酸钾溶液和双氧水的消毒原理相同 | |
| C. | 双氧水具有较强的腐蚀性,不能用于清洗创口 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
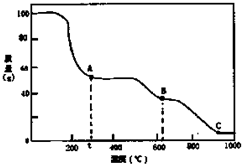
| A. | 0℃→t℃的过程变化是物理变化 | |
| B. | C点物质是工业上冶炼铝的原料 | |
| C. | A→B反应中生成物只有Al2(SO4)3和NH3两种 | |
| D. | Al2(SO4)3能够净水,其原理为:Al3++3OH?Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式 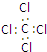 | B. | 乙炔的最简式 CH≡CH | ||
| C. | 聚乙烯的结构简式为 CH2=CH2 | D. | 丙烷的分子结构模型示意图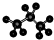 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com