
���� ��1���廯������Һ�������еμ�һ��������ˮ����Һ��ƣ�������Ӧ��Fe2+��ԭ�Դ���Br-�������Ժ��������ӷ�Ӧ���������ӣ��ٺ������ӷ�Ӧ�����嵥�ʣ��ݴ˷����жϣ�
��2�����������������������Һ�����ɺ�ɫ��Һ���Ǽ��������ӵķ�����
�ں�Fe2+�ֺ�Fe3+���ȼ�KSCN��Һ���ɫ���ٵμ���ˮ�ķ������ܼ�����Һ���Ƿ���Fe2+����Һ�д��ڵ�������Ҳ���л�ԭ���ܻ�ԭ�����������Һ��ɫ�����������������ӵ����������Լ����軯�ؼ����������ӵĴ��ڣ�
��3��Fel2��Һ�����ӻ�ԭ��I-��Fe2+��ͨ������������������Ϊ�ⵥ�ʣ�������Ӧ�������������ӣ��ݴ˷�Ӧ�Ķ�����ϵ���㣻
��� �⣺��1���廯������Һ�������еμ�һ��������ˮ����Һ��ƣ�������Ӧ��Fe2+��ԭ�Դ���Br-�������Ժ��������ӷ�Ӧ���������ӣ��ٺ������ӷ�Ӧ�����嵥�ʣ�
������Һ�к���Fe3+������ָ����������������Fe2+��Br2���ʢ���ȷ��
������Һ������ֻ������������һ���֣�����Һ�к���Fe2+��Fe3+����Br2���ʢ���ȷ��
������������ԭ��Ӧ˳���������Һ�к���Fe2+��Fe3+�����ܺ�Br2���ʢ۴���
����Һ�к���Br2�����������Ѿ�ȫ��������ΪFe3+��һ������Fe3+���ʢܴ���
�ʴ�Ϊ���٢ڣ�
��2�����ж���Һ���Ƿ���Fe3+������Һ�м���KSCN��Һ����Һ���ɫ˵��һ���������ӣ�ʵ�鷽���ɿ���
�ʴ�Ϊ���ɿ���
�������Һ�мȺ�Fe2+�ֺ�Fe3+���ȼ�KSCN��Һ����Һ���ɫ���ٵμ���ˮ�ķ������ܼ�����Һ���Ƿ���Fe2+������Һ�еμ�����KMnO4��Һ������KMnO4��Һ�Ƿ���ɫ���жϲ����ж����������ӻ�ԭ��ɫ���������ӻ�ԭ��ɫ�����Է������ɿ���������������������ػ����ɫ���������ʿ��Լ����������ӵĴ��ڣ�
�ʴ�Ϊ�����ܣ� ���ɿ�����ʱ����Һ�п��ܻ���Br-��Br-ͬ����ʹ����KMnO4��Һ��ɫ�� K3[Fe��CN��6]��
��3����100mL Fel2��Һ��ͨ��2.24LCl2����״��������Һ����$\frac{1}{2}$��Fe2+��������Fel2��Һ�����ӻ�ԭ��I-��Fe2+��ͨ������������������Ϊ�ⵥ�ʣ�������Ӧ�������������ӣ���⻯������ҺŨ��Ϊc����Fe2+���ʵ���=0.1cmol��I-���ʵ���=0.2cmol��n��Cl2��=$\frac{2.24L}{22.4L/mol}$=0.1mol��
2I-+Cl2=I2+2Cl-��
2 1
0.2c mol 0.1c mol
2Fe2++Cl2=2Fe3++2Cl-��
2 1
0.1cmol��$\frac{1}{2}$ �� 0.1-0.1c��mol
2�� 0.1-0.1c��mol=0.1cmol��$\frac{1}{2}$
c=0.8mol/L��
n��Cl2��=0.1mol��n��I-��=0.16mol��n��Fe2+��=0.04mol��
n��Fe2+����n��I-����n��Cl2��=0.04��0.16��0.1=2��8��5����Ӧ�����ӷ���ʽΪ��2Fe2++8I-+5Cl2=10Cl-+4I2+2Fe3+��
�ʴ�Ϊ��2 Fe2++8 I-+5Cl2=10 Cl-+4 I2+2Fe3+�� 0.8mol/L��
���� ���⿼����������ԭ��Ӧ�����Ӽ��顢�������ʡ���Ӧ��������Ͳ����жϣ����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
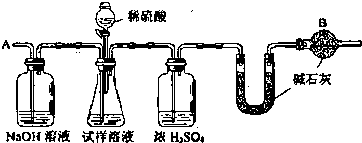
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������һ�����������Ļ����� | |
| B�� | �����������ͨʽCnH2n-6��n��6���Ļ����� | |
| C�� | ������������ | |
| D�� | ��������ͬϵ����ܳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Ȼ���Ľ����������� | |
| B�� | ��С��Ȼ���Ľ���ͯ����������Ľ����� | |
| C�� | ��������Ȼ���Ľ���ͯ������ | |
| D�� | ������Ȼ���Ľ��������С�����Ľ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | H+��Na+��A13+��Ag+��Ba2+ |
| ������ | OH-��C1-��CO32-��NO3-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
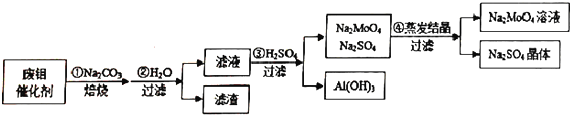
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ӵ�����Ǣڣ��٣��ۣ��� | |
| B�� | �������ӵ�����Ǣ٣��ۣ��ܣ��� | |
| C�� | �������ʶ��з�����������ԭ��Ӧ | |
| D�� | ���������ڷ�Ӧ��ת����2 mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cu2+��K+��NO3-��CO32- | B�� | Fe3+��NH4+��SO42-��NO3- | ||
| C�� | Fe2+��Na+��Cl-��ClO- | D�� | H+��Cl-��SO42-��C6H5O- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com