
| A、39 | B、41 | C、43 | D、45 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
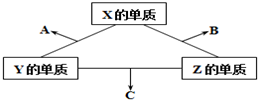 有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:
有X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化,已知一个B分子中含有Z元素的原子个数比一个C分子中含有Z元素的原子个数的少1个.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷 | B、乙烯 | C、乙烷 | D、丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
| B、c(Fe3+)=0.1mol?L-1的溶液中:Na+、NH4+、SCN-、SO42- |
| C、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D、0.1mol?L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4 溶解度增大、Ksp不变 |
| B、BaSO4 溶解度、Ksp均增大 |
| C、BaSO4 溶解度不变、Ksp增大 |
| D、BaSO4 溶解度、Ksp均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
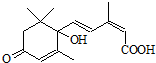 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )| A、其分子中含有一个手性碳原子 |
| B、只能发生加聚反应,不能发生缩聚反应 |
| C、1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P100kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com