
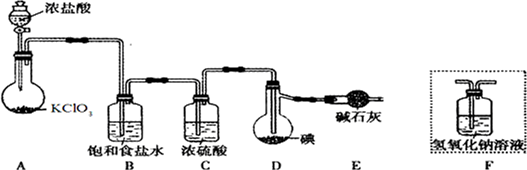
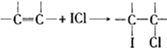
分析 由实验装置可知,A中氯酸钾具有氧化性能把浓盐酸氧化生成氯气,发生KClO3+6HCl=KCl+3Cl2↑+3H2O;浓盐酸易挥发生成的氯气中含有氯化氢,所以装置B中饱和食盐水的作用是除去氯气中的氯化氢,已知ICl易水解,若用装置F代替装置E,则装置F中的水蒸气会进入装置D中,使ICl水解,所以不能用装置F代替装置E;由于ICl与ICl3的沸点相差较大,因此若所制得的ICl中溶有少量ICl3杂质,提纯的方法是蒸馏,以此解答(1)~(3),
(4)①由于碘遇淀粉显蓝色,因此滴定过程中可用淀粉溶液作指示剂;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应溶液就会褪色,从而导致消耗硫代硫酸钠的量减小;
③实验2中比实验1多消耗的溶液体积为(V2-V1)mL,则Na2S2O3的物质的量的是0.001a(V2-V1)mol,根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,以此计算.
解答 解:(1)氯酸钾具有氧化性能把浓盐酸氧化生成氯气,则装置A中发生反应的化学方程式是KClO3+6HCl=KCl+3Cl2↑+3H2O,
故答案为:KClO3+6HCl=KCl+3Cl2↑+3H2O;
(2)浓盐酸易挥发生成的氯气中含有氯化氢,所以装置B中饱和食盐水的作用是除去氯气中的氯化氢,已知ICl易水解,若用装置F代替装置E,则装置F中的水蒸气会进入装置D中,使ICl水解,所以不能用装置F代替装置E,
故答案为:除去氯气中的氯化氢;装置F中的水蒸气会进入装置D中,使ICl水解;
(3)由于ICl与ICl3的沸点相差较大,因此若所制得的ICl中溶有少量ICl3杂质,提纯的方法是蒸馏,故答案为:C;
(4)①由于碘遇淀粉显蓝色,因此滴定过程中可用淀粉溶液作指示剂,故答案为:淀粉溶液;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应溶液就会褪色,从而导致消耗硫代硫酸钠的量减小,即会导致V1偏小,故答案为:偏小;
③实验2中比实验1多消耗的溶液体积为(V2-V1)ml,则Na2S2O3的物质的量的是0.001a(V2-V1)mol,根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,由根据方程式①可知,5.00g该油脂样品所消耗的ICl的物质的量为0.001a(V2-V1)mol×$\frac{1}{2}$×$\frac{100mL}{10mL}$=5a(V2-V1)×10-3mol,
故答案为:5a(V2-V1)×10-3.
点评 本题考查物质制备实验方案设计,为高频考点,侧重于实验原理、基本操作、物质性质、数据处理等知识的考查,把握制备原理、实验装置的作用、混合物分离提纯方法为解答的关键,注意物质含量测定的计算方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
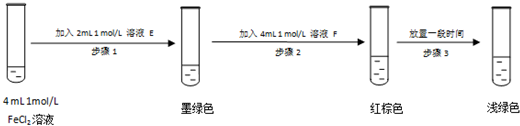
 Fe(OH)3+3H+和SO32-+H2O
Fe(OH)3+3H+和SO32-+H2O  HSO32-+OH-逆向进行,溶液变为浅绿色.
HSO32-+OH-逆向进行,溶液变为浅绿色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
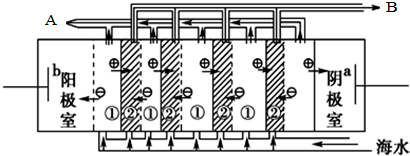 ,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.
,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
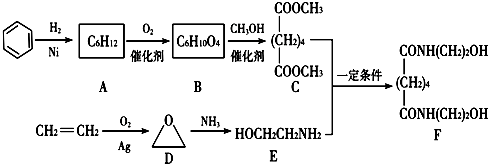
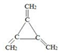 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 将淀粉在酸性条件下水解后直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 除去苯中的苯酚的方法是:加溴水,振荡,过滤除去沉淀 | |
| D. | 除去混入CH3CH2OH中的蚁酸HCOOH:加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+):④>③>①>② | |
| B. | ①、②和③等体积混合后的溶液:pH=7 | |
| C. | c(NH4+):③>④>① | |
| D. | ①和②等体积混合后的溶液:c(NH4+)+c(NH3•H2O)=0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com