
室温下向10 mL c(H+)=10-3 mol·L-1的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中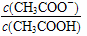 变大
变大
C.醋酸的电离程度增大,c(OH-)亦增大
D.再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应
科目:高中化学 来源: 题型:
氯仿(CHCl3)可作全身麻醉剂,但在光照下易被氧化生成光气(COCl2):2CHCl3+O2 2COCl2+2HCl,为防止事故的发生,使用前先检验是否变质,你认为检验用的最佳试剂是( )
2COCl2+2HCl,为防止事故的发生,使用前先检验是否变质,你认为检验用的最佳试剂是( )
A.烧碱溶液 B.溴水
C.AgNO3溶液 D.KI淀粉试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
对1 mol/L的BaCl2溶液的有关叙述中,正确的是
A.该溶液中Cl-浓度为0.5 mol/L
B.该溶液中Ba2+的物质的量是1 mol
C.该溶液中Ba2+和Cl-的物质的量之比为1:2
D.将208 g BaCl2固体溶解在1 L水中,所得溶液的浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验:
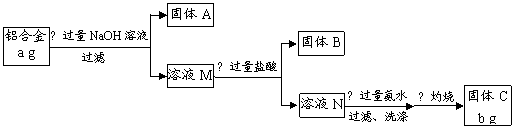 |
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
请回答下列问题:
(1)固体A的成分是 ▲ ;
(2)生成固体B的离子方程式为 ▲ ;
步骤③中生成沉淀的离子方程式为 ▲ ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为 ▲
;
(4)该样品中铝的质量分数是 ▲ ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ▲ ;
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第③步中沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组为研究电化学原理,设计如下图装置,下列叙述不正确的是

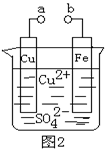
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,溶液中的SO42-向铁电极移动,铜片上发生的反应为:
Cu2++2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极, 溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图所示装置进行实验,并回答下列问题:
|

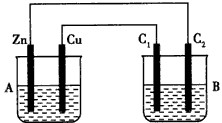

(1)判断装置的名称:A池为__________________,B池为________________________。
(2)铁极为_________极,电极反应式为________________________;
铜极为________极,电极反应式为________________________ ;
石墨棒C1为_______极,电极反应式为____________________________;石墨棒C2附近发生的实验现象为________,反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水)
(3)当C2极析出224 mL气体(标准状况下),铁的质量________(增加或减少)__________g
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言来描述,下列有关化学用语错误的是
A.氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH-
B.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2++2 e-=Cu
C.用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:
2C1-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
D.钢铁发生电化学腐蚀的负极反应式:Fe一2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
 (1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
①从反应开始到3 min时,氢气的平均反应速率v(H2)=________。
②下列措施中一定能使CO2的转化率增 大的是_______。
大的是_______。
A.在原容器中再充入1 mol H2
B.在原容器中再充入1 mol CO2
C.缩小容器的容积
D.使用更有效的催化剂
E.在原容器中充入1 mol He
F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。
请根据表中数据回答下列问题。
|
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值________(填“增大”、“减小”或“不变”)。
③增大的值,则生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能
确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表,相关说法正确的是
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
A.离子半径大小:r(M3+) >r(T2-) B.其中R的金属性最强
C.煤和石油中存在X元素 D.L、X形成的简单离子核外电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com