
| A. | 前者大于后者 | B. | 前者小于后者 | ||
| C. | 两者相等 | D. | 没有相关燃烧热数据,无法对比 |
科目:高中化学 来源: 题型:选择题
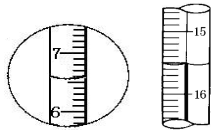
| A. | 左边是量筒读数6.5mL,右边是滴定管读数16.50mL | |
| B. | 左边是量筒读数7.5mL,右边是滴定管读数16.50mL | |
| C. | 左边是量筒读数6.5mL,右边是滴定管读数15.50mL | |
| D. | 左边是量简读数6.5mL,右边是滴定管读数16.50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 9.8 | 96.4 | 93.0 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
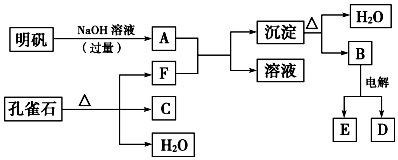
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数不同 | B. | 质子数相同 | C. | 氧原子数相同 | D. | 气体质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀的PH | 沉淀完全的PH |
| Cr3+ | 4.9 | 6.8 |
| Fe3+ | 1.5 | 4.1 |
| 物质 | 溶解度/(g/110g水) | ||
| 0℃ | 40℃ | 80℃ | |
| K2SO4 | 7.4 | 14.8 | 21.4 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| 实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 24.98 |
| 2 | 25.00 | 1.56 | 29.30 |
| 3 | 25.00 | 1.00 | 26.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A可以形成+1价阳离子 | B. | B的最高价为+6价 | ||
| C. | Z一定可以与水反应 | D. | Z中不可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| BaCO3 | BaSO4 | BaSO3 | BaS2O3 |
| 5.1×10-9 | 1.1×10-10 | 8.4×10-7 | 1.6×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某温度下,在2L密闭容器中发生反应:3A(g)+bB (g)?4C(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,反应物的物质的量的浓度(c)随时间(t)的变化如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中发生反应:3A(g)+bB (g)?4C(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,反应物的物质的量的浓度(c)随时间(t)的变化如图所示.下列说法正确的是( )| A. | 12s内,A的平均反应速率为0.025mol•L-1•s-1 | |
| B. | A的消耗反应速率等于B的消耗反应速率 | |
| C. | 第12s后,平衡体系的温度逐渐下降 | |
| D. | 12s内,A和B反应放出的热量为0.4Q kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com