
| A. | 上述灼烧过程的尾气均可直接排到空气中 | |
| B. | 由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2中,作氧化剂的只有Cu2O | |
| D. | 电解精炼时,粗铜应与外电源正极相连 |
分析 A.根据尾气SO2气体的性质判断能否直接排空;
B.根据最终产物为Cu、SO2和FeO可写出反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据总反应方程式判断;
C.根据反应物各元素的化合价的变化判断;
D.精炼铜时,粗铜做阳极.
解答 解:A.SO2有毒,不能直接排放到空气中,故A错误;
B.反应的总反应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,6molCuFeS2生成6molCu,共消耗15molO2,故B正确;
C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,Cu的化合价由+1价升高为+2价,S的化合价由-2价升高为+4价,反应物中Cu2O只做氧化剂,Cu2S既是氧化剂又是还原剂,故C错误;
D.精炼铜时,粗铜做阳极,与电源的正极相连,故D正确.
故选BD.
点评 本题考查金属的冶炼以及氧化还原有关知识,题目难度不大,注意分析C项中各元素的化合价的变化特点,以正确分析氧化剂和还原剂.


科目:高中化学 来源: 题型:选择题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 电解后溶液pH=0 | B. | a=3 | ||
| C. | 阳极生成1.5mol Cl2 | D. | 阴极析出的金属是铜与铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{13}$C的质量数是13,原子序数是6,核内有6个中子 | |
| B. | ${\;}_{6}^{13}$C与金刚石、石墨、C60等互为同素异形体 | |
| C. | ${\;}_{6}^{13}$C与${\;}_{6}^{12}$C是两种不同的碳元素 | |
| D. | ${\;}_{6}^{13}$C是碳的一种核素,与${\;}_{6}^{12}$C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀中氢氧根的质量为5.1g | B. | V为2.24L | ||
| C. | Cu的物质的量为0.1mol | D. | 反应后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
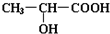
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
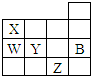
| A. | 常压下,五种元素的单质中,Z单质的沸点最高 | |
| B. | X的氢化物沸点比W的氢化物沸点高 | |
| C. | Y元素氧化物的水化物酸性比W的强 | |
| D. | Y、Z的简单阴离子的电子层结构都与B原子的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中加入铁粉:Fe+Fe3+═2Fe2+ | |
| B. | NH4HSO4溶液中加入少量NaOH:NH4++OH-═NH3•H2O | |
| C. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 氯气通入Na2SO3溶液中:Cl2+SO32-+H2O═SO42-+2H++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液加入几滴KSCN溶液后不变色再滴加几滴氯水后,溶液变红,说明该溶液一定有Fe2+ | |
| B. | 某溶液滴加AgNO3溶液产生白色沉淀,说明该溶液一定含Cl- | |
| C. | 某溶液加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,说明该溶液一定有CO32- | |
| D. | 某溶液滴加盐酸酸化的BaCl2溶液后,有白色沉淀产生,说明该溶液一定含SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com