
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论叙述正确的是
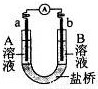
选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
B | Cu | Zn | 稀H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
C | C | C | FeCl3 | KI、淀粉混 合液 | b极附近溶液变蓝 |
D | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源:2014高考名师推荐化学NA与粒子(解析版) 题型:填空题
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O △H2= -534.2kJ·mol-1
写出肼和N2H4反应的热化学方程式 ;
(3)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:简答题
【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为 ;
(2)AB32-的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为 ,1mol B22+中含有的π键数目为 。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键 。
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为a g/cm3,则晶胞的体积是 (只要求列算式,阿伏加德罗常数的值为NA)

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:简答题
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:

(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时 | 3.4 | 6.3 | 2.7 |
完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)H2SO4溶解A12O3的离子方程式是 ;
(2)检验滤液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的 ;调节溶液的pH为3.2的目的是 。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ,写出其反应方程式 ;
③Ⅲ中加入MnSO4的目的是 。
(4)从多次循环使用后母液中可回收的主要物质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列关于实验操作的叙述正确的是
A.用四氯化碳萃取溴水中的溴时,将溴的四氣化碳溶液从分液漏斗下口放出
B.用氢氧化钠溶液滴定盐酸的实验中,可通过旋转玻璃活塞调节滴定速率
C.在配制一定物质的量浓度溶液的实验中,若定容时加水超过刻度线应立即用滴管吸出少量水
D.用玻璃棒蘸取溶液滴到放在洁净表面皿上用蒸锻水润湿的pH试纸上,测溶液的pH
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:简答题
【有机物化学基础】
以下是一种药物Ⅳ合成部分路线:

请回答下列问题:
(1)化合物Ⅰ的分子式为 ,它长期暴露在空气中会变质,其原因是 。
(2)化合物Ⅰ转化为Ⅱ的反应类型是 。
(3)化合物Ⅰ的同分异构体A含α-氨基苯乙酸,A的苯环对位含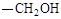 ,则A的结构简式是 ,A在催化剂的作用下通过肽键形成高聚物,试写出该反应的化学方程式 。
,则A的结构简式是 ,A在催化剂的作用下通过肽键形成高聚物,试写出该反应的化学方程式 。
(4)写出Ⅲ的结构简式 。
(5)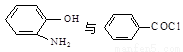 在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反应,试写出该反应的化学方程式 。
在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反应,试写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
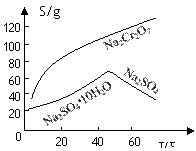
从化工厂铬渣中提取硫酸钠的工艺如下:
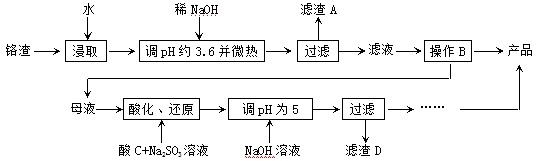
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+ ;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学
式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填
字母序号)
A.蒸发浓缩,趁热过滤 B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为:
;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:简答题
乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO
和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是 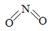 和
和 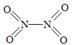 。
。
物质 | NO2 | N2O4 | |
化学键 | N=O | N—N | N=O |
键能(kJ/mol) | 466 | 167 | 438 |
写出NO2转化N2O4的热化学方程式 。
(3)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式 。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
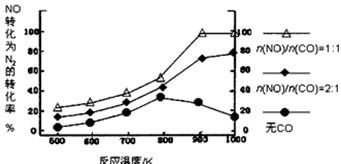
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别 为 、 ;该反应的?H 0(填“>”、“<”或“=”)。
(4)用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO 发生反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com