
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管、烧杯 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、玻璃棒、温度计 |
| D | 分离苯和苯酚的混合物 | 分液漏斗、烧杯 |
| A. | A | B. | B | C. | C | D. | .D |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 | |
| B. | 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成大量的SO3 | |
| D. | 富含硫黄的矿物在工业上可用于制造硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
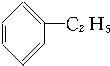 ②
②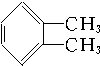 ③
③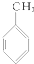 ④
④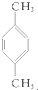
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1 mol•L-1的溶液中,pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | 升高温度,HCN溶液中H+浓度增大,平衡正向移动,电离平衡常数增大 | |
| C. | 向稀醋酸中逐滴加水,或加入少量冰醋酸,CH3COOH的电离平衡都正向移动 | |
| D. | 向CH3COOH溶液中加入少量氢氧化钠固体,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
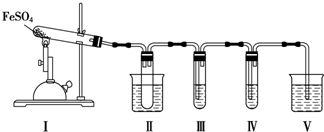
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有0.5mol•L-1BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有0.01mol•L-1酸性KMnO4溶液(或0.0l mol.L-1 溴水) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| B. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| C. | 高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com