
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应: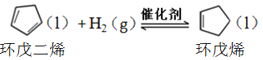 ,
,![]()
副反应: ,
,![]()
解聚反应: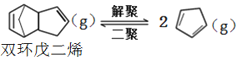 ,
,![]()
回答下列问题:
(1)反应![]() 的△H= _____ kJ/mol。
的△H= _____ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:
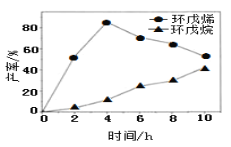
①0~4h氢化反应速率比副反应快的可能原因是_________。
②最佳的反应时间为__h。若需迅速减慢甚至停止反应,可采取的措施有____(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是 ____(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则p(H2O)=______kPa,平衡常数Kp=_______kPa (Kp为以分压表示的平衡常数)。
【答案】-209.9 氢化反应的活化能小或反应物的浓度大 4 排出氢气或急剧降温 副反应增加 CD 50 3200
【解析】
(1)结合盖斯定律计算,氢化反应+副反应得到反应的△H;
(2)①根据活化能或浓度对反应速率的影响分析;
②根据图象可知,在4h时环戊烯产率最大、环戊烷产率较小;根据外界条件对化学反应速率的影响分析迅速减慢甚至停止反应的措施。
③副反应增加导致环戊烯的产率降低;
(3)①根据影响化学平衡移动的因素及物质的转化率的变化分析;
②用三段式法先计算物质的平衡物质的量,根据物质在同温同体积时压强比等于气体的物质的量之比计算平衡常数及物质产生的压强大小。
(1)结合盖斯定律计算,氢化反应+副反应得到反应![]() △H=-209.9kJ/mol;
△H=-209.9kJ/mol;
(2)①0~4h氢化反应速率比副反应快的可能原因是氢化反应的活化能小或反应物的浓度大;
②根据图象可知,在4h时环戊烯产率最大、环戊烷产率较小,说明最佳的反应时间为4h;若需迅速减慢甚至停止反应,可采取的措施有:排出氢气,或利用温度对化学反应速率的影响,将反应体系的温度降低,即急剧降温也可以降低反应速率;
③一段时间后,环戊烯产率快速下降的原因可能是副反应增加,导致环戊烯的产率降低;
(3) A.增大双环戊二烯的用量,平衡正向移动,但是加入的双环戊二烯使平衡正向移动消耗量远小于增大双环戊二烯的用量使其浓度增大的量,因此增大双环戊二烯的用量,双环戊二烯的转化率降低,A错误;
B.使用催化剂化学平衡不发生移动,双环戊二烯的平衡转化率不变,B错误;
C.及时分离产物,由于生成物浓度降低,平衡正向移动,使更多的双环戊二烯发生反应,因此双环戊二烯的转化率增大,C正确;
D.由于该反应的正反应是吸热反应,适当提高温度,化学平衡正向移动,使更多的双环戊二烯发生反应,因此双环戊二烯的转化率增大,D正确;
故答案是CD;
②假设反应前双环戊二烯的物质的量为a,水蒸气的物质的量为b,
化学反应: 
n(开始)(mol) a 0
n(转化)(mol) 0.8a 1.6a
n(平衡)(mol) 0.2a 1.6a
在同温同体积时,气体的压强与气体的物质的量呈正比,反应前总压为300 kPa,反应达到平衡后总压为500 kPa,![]() ,解得
,解得![]() ,由于反应前气体的总压强为300kPa,所以p(H2O)=
,由于反应前气体的总压强为300kPa,所以p(H2O)=![]() ×300kPa=50kPa,
×300kPa=50kPa,![]() ,由于
,由于![]() ,所以p(双环戊二烯) 平衡=50kPa,p(环戊二烯)平衡=
,所以p(双环戊二烯) 平衡=50kPa,p(环戊二烯)平衡=![]() p(双环戊二烯)平衡=8×50kPa=400kPa,所以平衡常数Kp=
p(双环戊二烯)平衡=8×50kPa=400kPa,所以平衡常数Kp=![]() =3200kPa。
=3200kPa。


科目:高中化学 来源: 题型:
【题目】反应物和生成物均为气态的平衡体系,平衡常数表达式为K=![]() ,有关该平衡体系的说法错误的是
,有关该平衡体系的说法错误的是
A. 升高温度,该反应平衡常数K的变化无法判断
B. 增大压强,W的质量分数减小
C. 该反应的化学方程式为3Z(g)+2W(g)![]() X(g)+2Y(g)
X(g)+2Y(g)
D. 增大X气体的浓度平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其他无机原料合成环状酯E和髙分子化合物H的示意图如图所示:

请回答下列问题:
(1)写出以下物质的结构简式:B______,G_______
(2)写出以下反应的反应类型:X_____,Y______.
(3)写出以下反应的化学方程式:A→B:_______
(4)若环状酯E与NaOH水溶液共热,则发生反应的化学方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:
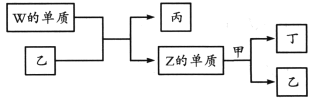
下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法测室内甲醛含量的原理为:
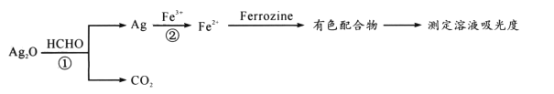
已知:吸光度与溶液中有色物质的浓度成正比
下列说法正确的是
A. 反应①中参与反应的HCHO为30g时转移电子2mol
B. 可用双氧水检验反应②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol
D. 理论上测得溶液吸光度越高,HCHO含量也越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式书写不正确的是
A. 用铜电极电解MgCl2溶液:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
C. 向Ba(OH)2溶液中加入NaHSO4至溶液为中性:Ba2++2OH-+2H++![]()
![]() BaSO4↓+2H2O
BaSO4↓+2H2O
D. 酸性介质中KMnO4氧化H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活、环境保护、资源利用等密切相关,下列说法正确的是
A. 大米、玉米、小麦中的淀粉经水解可变成乙醇
B. 利用二氧化碳制造全降解塑料,可以缓解温室效应
C. 测定氢氧化钠的熔点时,可以将氢氧化钠固体放入石英坩埚中高温加热
D. 海洋中含有丰富的矿产资源,仅利用物理方法可以获得![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中投入1molCH3COOCH3(l)和1molC6H13OH(l)发生反应:CH3COOCH3(l)+C6H13OH(l) ![]() CH3COOC6H13(l)+CH3OH(l)。测得体系中CH3OH的物质的量与时间的变化关系如图所示。
CH3COOC6H13(l)+CH3OH(l)。测得体系中CH3OH的物质的量与时间的变化关系如图所示。
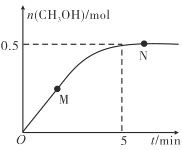
回答下列问题:
(1)CH3COOCH3的一种同分异构体属于酸,它的结构简式为___。
(2)己醇(C6H13OH)中,含3个甲基的结构有___种(不考虑立体异构)。
(3)M点:正反应速率___逆反应速率(填“大于”“小于”或“等于”,下同)。N点正反应速率___M点逆反应速率。
(4)上述反应在0~5min内CH3COOCH3的平均反应速率为___mol·min-1。
(5)上述反应达到平衡时,C6H13OH的转化率为___%。
(6)N点混合物中CH3COOC6H13的物质的量分数为___%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com