
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有吸水性,故可用来与蔗糖反应做“黑面包”实验 | |
| C. | 稀H2SO4与铁、铝反应,浓H2SO4在常温下不与铁、铝反应 | |
| D. | 浓硫酸与铜片加热反应,既表现了酸性,又表现出强氧化性 |
分析 A.硫酸中硫元素、氢元素都处在最高价态,能够降价;
B.浓硫酸能够使蔗糖脱水变黑;
C.依据浓硫酸的强氧化性解答;
D.依据铜与浓硫酸反应生成硫酸铜、二氧化硫和水,结合反应中硫元素化合价变化解答.
解答 解:A.硫酸中硫元素、氢元素都处在最高价态,能够降价,所以无论浓硫酸还是稀硫酸都具有氧化性,故A错误;
B.浓硫酸能够使蔗糖变黑,体现浓硫酸的脱水性,故B错误;
C.浓硫酸具有强氧化性,常温下能够使铁、铝发生钝化,钝化属于化学反应,故C错误;
D.铜与浓硫酸反应生成硫酸铜、二氧化硫和水,浓硫酸中部分硫元素化合价降低,表现为氧化性,部分化合价不变,表现为酸性,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉浓硫酸的脱水性、强氧化性、吸水性是解题关键,注意氧化还原反应基本概念的判断,注意浓硫酸吸水性与脱水性区别,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 蒸发FeCl3溶液,得到FeCl3固体 | |
| B. | 在FeCl3、CuCl2混合液中,加入少量Fe粉,一定有H2产生且有Cu析出 | |
| C. | 用FeCl3固体溶于水配制饱和溶液,会有Fe(OH)3沉淀产生 | |
| D. | 在FeCl3溶液中,加入KHCO3溶液,有CO2产生,但无Fe(OH)3沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
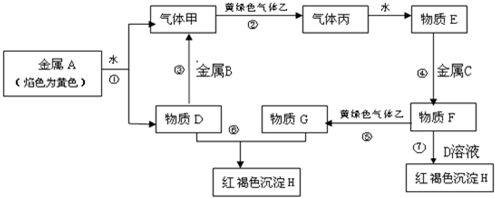
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA | |
| C. | 7.8 g Na2O2含有的阴离子数目为0.1 NA | |
| D. | 80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体中的铁离子和氯离子可用渗析法除去 | |
| B. | 硬脂酸钠中混有少量的甘油,用盐析法除去 | |
| C. | 乙酸乙酯中混有少量乙酸,用饱和碳酸钠溶液洗涤后分液 | |
| D. | 氯化钠中有少量氯化铵,加过量的烧碱溶液后加热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NaCl中少量的KNO3,可将固体混合物制成热饱和溶液,冷却结晶、过滤 | |
| B. | 探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生浑浊的快慢,来反映试剂反应速率的大小.从而探究浓度,温度等外界条件对该反应的化学反应速率的影响 | |
| C. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| D. | 为了加快反应速率得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径 (×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
主要化合价 | 最高 正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低 负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | H2Q的还原性和稳定性大于RH3 | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM,YM都是电解质,熔融状态下都能电解 | |
| D. | 元素Z、M组成的化合物熔化时破坏了离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com