
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Z)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A. | 若使用催化剂,则反应速率和X的转化率均增大 | |
| B. | 其他条件不变,升高温度,再达到平衡时c(Z)=0.8 mol•L-1,则△H>0 | |
| C. | 其他条件不变,容器体积压缩到1.0 L,平衡常数将增大 | |
| D. | 温度不变,向容器中再充入2 mol X、1 mol Y,反应达到新平衡时 $\frac{n(Z)}{n(Y)}$ 增大 |
分析 由表中数据可知6s时达到平衡.
A.加入催化剂,平衡不移动;
B.由表中数据可知达到平衡时,c(Z)=$\frac{1.8mol}{2L}$=0.9 mol•L-1,升高温度,再达到平衡时c(Z)=0.8 mol•L-1,说明平衡逆向移动;
C.平衡常数只受温度的影响;
D.温度不变,向容器中再充入2 mol X、1 mol Y,相当于在原来的基础上缩小体积,增大压强.
解答 解:A.加入催化剂,平衡不移动,物质的转化率不变,故A错误;
B.由表中数据可知达到平衡时,c(Z)=$\frac{1.8mol}{2L}$=0.9 mol•L-1,升高温度,再达到平衡时c(Z)=0.8 mol•L-1,说明平衡逆向移动,则正反应为放热反应,故B错误;
C.平衡常数只受温度的影响,缩小体积,平衡常数不变,故C错误;
D.温度不变,向容器中再充入2 mol X、1 mol Y,相当于在原来的基础上缩小体积,增大压强,平衡正向移动,则反应达到新平衡时 $\frac{n(Z)}{n(Y)}$ 增大,故D正确.
故选D.
点评 本题考查化学平衡的计算以及平衡移动的影响因素,为高频考点,把握表中数据,把握速率和转化率的计算、判断为解答的关键,侧重分析与计算能力的考查,注意K只与温度有关,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫易溶于水 | B. | 用CCl4 萃取碘水中的碘 | ||
| C. | 氯气易溶于NaOH溶液 | D. | 苯与水混合静置后分层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼分子间含有氢键 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子呈正三角形,属非极性分子 | |
| D. | 其分子空间结构类似CH4O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转化①有利于碳参与自然界的元素循环 | |
| B. | 转化②中S和O2属于不同的核素 | |
| C. | 可用澄清的石灰水鉴别CO2与SO2 | |
| D. | 转化的热化学方程式是:2CO(g)+SO2(g)═S(s)+2CO2 (g)△H=+270kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
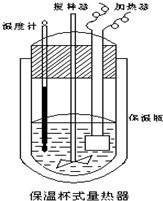 在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )
在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )| A. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| B. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 | |
| C. | 若量热计的保温瓶绝热效果不好,则所测△H偏大 | |
| D. | CH3COOH的中和热△H为-53.3KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 CO2+4HCl.
CO2+4HCl.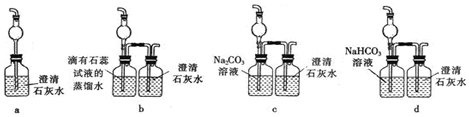
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com