
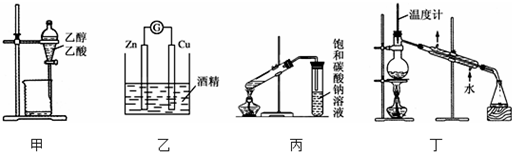
| A. | 甲装置可用来分离乙醇和乙酸 | |
| B. | 乙装置可以构成原电池 | |
| C. | 在制备乙酸乙酯的实验中,丙装置中的饱和碳酸钠可以用氢氧化钠溶液代替 | |
| D. | 丁装置可以用来分离乙醇和丁醇和混合物 |
分析 A.乙酸和乙醇互溶,不能通过分液操作分离;
B.锌和铜都不与酒精反应,该装置无法构成原电池;
C.氢氧化钠溶液能够与乙酸乙酯反应,不能用氢氧化钠溶液取代饱和碳酸钠溶液;
D.根据蒸馏操作中温度计位置、冷凝管通水方向分析.
解答 解:A.乙酸易溶于乙醇,无法通过分液的方法分离乙醇和乙酸,故A错误;
B.乙装置中缺少电解质溶液,无法构成原电池,故B错误;
C.NaOH能够与乙酸乙酯反应,不能用浓氢氧化钠溶液代替饱和碳酸钠溶液,故C错误;
D.图示装置中,冷凝管放在蒸馏烧瓶的支管口处,冷凝管采用逆向通水,该装置能够用来分离乙醇和丁醇和混合物,故D正确;
故选D.
点评 本题考查了化学实验方案的设计与评价,题目难度中等,明确常见化学实验基本操作方法为解答关键,试题侧重基础知识的考查,有利于提高学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:实验题
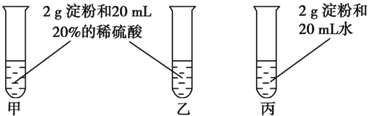
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
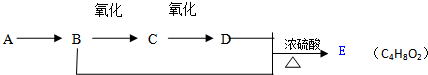
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的一取代物无同分异构体 | |
| B. | 苯不易跟溴、氯发生加成反应 | |
| C. | 苯分子中碳原子之间以单双键交替存在 | |
| D. | 苯不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 质子数相同的微粒,它们的化学性质基本相同 | |
| C. | 苯和溴苯的混合物可用分液法分离 | |
| D. | 由“C(石墨)→C(金刚石)△H=+1.9 kJ/mol”可知石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷晶体中,分子之间通过共价键结合 | |
| B. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| C. | 在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-或(Na+) | |
| D. | 离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子核外有114个电子 | B. | 该原子的质子数是184 | ||
| C. | 第七周期有50种元素 | D. | 该元素的相对原子质量是298 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
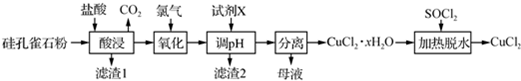
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com