
 =1.0×10-5mol/l,碳酸钡的溶度积Ksp=[Ba2+][CO32-]=2.58×10-9,则[CO32-]=
=1.0×10-5mol/l,碳酸钡的溶度积Ksp=[Ba2+][CO32-]=2.58×10-9,则[CO32-]= =
= =2.58×10-4(mol/l),转化的离子反应方程式为:BaSO4+CO32-≒BaCO3+SO42-,故答案为:2.58×10-4,BaSO4+CO32-≒BaCO3+SO42-.
=2.58×10-4(mol/l),转化的离子反应方程式为:BaSO4+CO32-≒BaCO3+SO42-,故答案为:2.58×10-4,BaSO4+CO32-≒BaCO3+SO42-.

科目:高中化学 来源: 题型:阅读理解
 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品l.5g,加入稀硫酸25mL,用水稀释至50ml,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液. |
| ② | 取少量滤液,滴加KSCN溶液,不显红色 取少量滤液,滴加KSCN溶液,不显红色 |
| ③ | 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 |
| ④ | 取上述褪色后的溶液,滴加KSCN溶液显红色 取上述褪色后的溶液,滴加KSCN溶液显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013届甘肃省甘谷一中高三第五次检测化学试卷(带解析) 题型:填空题
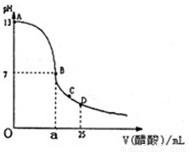
I.如图1为向25mL 0.1mol·L—1NaOH溶液中逐滴滴加0.2mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。请回答:
⑴ B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间(若正确,此问不答)。
⑵关于该滴定实验,从下列选项中选出最恰当的一项________(选填字母)。
| | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 酚酞 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 石蕊 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省高三第五次检测化学试卷(解析版) 题型:填空题
I.如图1为向25mL 0.1mol·L—1NaOH溶液中逐滴滴加0.2mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。请回答:

⑴ B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间(若正确,此问不答)。
⑵关于该滴定实验,从下列选项中选出最恰当的一项________(选填字母)。

锥形瓶中溶液 滴定管中溶液 选用指示剂 选用滴定管
A 碱 酸 酚酞 (乙)
B 酸 碱 甲基橙 (甲)
C 碱 酸 石蕊 (甲)
D 酸 碱 酚酞 (乙)
⑶ AB区间,c(OH—)>c(H+),则c(OH—)与c(CH3COO—)大小关系是________。
A.c(OH—)大于c(CH3COO—) B.c(OH—)小于c(CH3COO—)
C.c(OH—)等于c(CH3COO—) D.上述三种情况都可以
⑷在D点时,溶液中c(CH3COO—)+c(CH3COOH)________2c(Na+)(填“>”“<”或“=”)。
Ⅱ.t℃时,某稀硫酸溶液中c(H+) = 10—a mol·L—1,c(OH-) = 10—b mol·L—1,已知a+b=13:
⑸该温度下水的离子积常数Kw的数值为________。
⑹该温度下(t℃),将100mL 0.1mol·L—1的稀H2SO4与100mL 0.4mol·L—1的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com