
����Ŀ��X��Y��Z��M��WΪ���ֶ�����Ԫ�ء�X��Y��Z��ԭ���������������ͬ����Ԫ�أ�������������֮��Ϊ15��X��Z���γ�XZ2���ӣ�Y��M�γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76 g��L��1��W����������X��Y��Z��M����Ԫ��������֮�͵�![]() ������˵����ȷ����(����)
������˵����ȷ����(����)
A. ԭ�Ӱ뾶��W>Z>Y>X>M
B. XZ2��X2M2��W2Z2��Ϊ���ۻ�����
C. M2Z2��ǿ�����ԣ�������ֻ�й��ۼ�
D. ��X��Y��Z��M����Ԫ���γɵĻ�����һ���������Ӽ������й��ۼ�
���𰸡�C
���������������������֪��X��Y��Z��M��W�����ֶ�����Ԫ�ص����У����ǰ�ԭ���������ε������еģ�����ֻ��X��Y��Z����Ԫ����ԭ���������ε�����ͬ����Ԫ�أ���X��Y��Z������������֮��Ϊ15��X��Z���γ�XZ2���ӣ����Ƴ�X��Y��Z�ֱ�ΪC��N��O����Ԫ�أ�����Y��M�γɵ���̬�������ڱ�״���µ��ܶ�0.76gL-1���Ϳɼ��������̬�������Ħ������Ϊ22.4L/mol��0.76gL-1=17g/mol���Ӷ�ȷ��MΪHԪ�أ�����W����������X��Y��Z��M����Ԫ��������֮�͵�![]() ���Ƴ�W��������Ϊ
���Ƴ�W��������Ϊ![]() ��6+7+8+1��=11������WΪNaԪ�ء�A��ԭ�Ӱ뾶Ӧ��W��X��Y��Z��M����Na��C��N��O��H������A����B��ѡ����CO2��C2H2��Ϊֱ�����ۻ������Na2O2�����ӻ��������ֱ�����ۻ������B����C�������������ǿ�����ԣ������д��ڼ��Թ��ۼ��ͷǼ��Թ��ۼ�����C��ȷ��D��X��Y��Z��M����Ԫ�ؿ��γɻ�������NH4��2CO3��NH4HCO3��CO��NH2��2�����أ��ȣ�ǰ����Ϊ���ӻ����������Ϊ���ۻ������D����ѡC��
��6+7+8+1��=11������WΪNaԪ�ء�A��ԭ�Ӱ뾶Ӧ��W��X��Y��Z��M����Na��C��N��O��H������A����B��ѡ����CO2��C2H2��Ϊֱ�����ۻ������Na2O2�����ӻ��������ֱ�����ۻ������B����C�������������ǿ�����ԣ������д��ڼ��Թ��ۼ��ͷǼ��Թ��ۼ�����C��ȷ��D��X��Y��Z��M����Ԫ�ؿ��γɻ�������NH4��2CO3��NH4HCO3��CO��NH2��2�����أ��ȣ�ǰ����Ϊ���ӻ����������Ϊ���ۻ������D����ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ԡ���ԭ�Ե�ǿ�������������ʵĽṹ�йأ��������ʵ�Ũ�Ⱥͷ�Ӧ�¶��йء����и������ʣ���Cu��HNO3��Һ ��Cu��FeCl3��Һ ��Zn��H2SO4��Һ ��Fe��HCl��Һ ����Ũ�Ȳ�ͬ���ܷ�����ͬ������ԭ��Ӧ����
A���٢� B���ۢ� C���٢� D���٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ȼ��һ���������ɫ��Դ����Ŀǰ�Դ����о���ʵ��Σ���δ�õ��㷺Ӧ�ã���ԭ�������
A�����������ˮ�Ʊ���ã���ˮ��Դ�����ѷ�
B�������Ʊ����ܾ��������⼼����δ����
C���������桢����Ȱ�ȫ�����Ѿ��ܺõؽ����
D������ȼ�ղ���������Ⱦ������ų���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��RΪ���ֶ�����Ԫ�أ���ԭ�Ӱ뾶������������֮��Ĺ�ϵ����ͼ��ʾ��
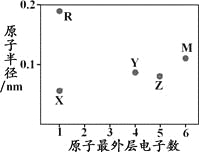
����˵������ȷ����
A. �������Ӱ뾶��X< R
B. ��ۺ���������ԣ�Z < Y
C. M���⻯�ﳣ�³�ѹ��Ϊ����
D. X��Y�����γ���������ṹ�ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������ܴ����������
A. Fe2+��H+��Na+��NO3�� B. Fe3+��Br-��Na+��I-
C. Fe3+��NH4+��H+��SO42- D. Mg2+��OH-��NH4+��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ijԪ�أ�2�����ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d9����Ԫ�������ڱ��е�λ����(����)
A.�������ڢ��壬p��B.�������ڢ�B�壬d��
C.�������ڢ�B�壬ds��D.�������ڢ�B�壬f��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֳ���طŵ�ʱ�ĵ缫��ӦΪ��H2+2OH--2e-=2H2O��NiO(OH)+H2O+e-=Ni(OH)2+OH-��Ϊ��س��ʱ�������Դ�������ӵĵ缫�Ϸ����ķ�Ӧ�� (����)
A. Ni(OH)2������ B. NiO(OH)�Ļ�ԭ C. H2������ D. H2O�Ļ�ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ص縺����ԭ�������ĵ�������ǿ���ǣ� ��
A. Na, K, Rb B. N, P, As C. O, S, Cl D. Si, P, Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������е�18��Ԫ�ؾ�����Ҫ����;�����ִ���ҵ�б���������
��1������һ��Ӳ���࣬����ʴ��ǿ�Ľ����������ڵ�ƺ��������ָ֣���̬Crԭ���У�����ռ������ܲ�ķ���Ϊ �����ܲ��Ͼ��е�ԭ�ӹ����Ϊ ��������Ϊ ��
��2����������Ԫ�صĵ�һ��������ԭ��������������������������ģ�30Zn��31Ga�ĵ�һ�������Ƿ������һ���ɣ� ����������������������ԭ���� �����ǰһ���������������ʿ��Բ��𣩣�
��3�������VA��Ԫ�ؿ��γɶ��������˹��뵼����ϣ��黯�أ�GaAs����������һ�֣��侧��ṹ��ͼ1��ʾ����ɫ�����Asԭ�ӣ�����GaAs�����У�ÿ��Gaԭ���� ��Asԭ����������ͬһ��Gaԭ��������Asԭ�ӹ��ɵĿռ乹��Ϊ ��
��4����Asͬ����Ķ�����Ԫ����N��P��AsH3����ԭ���ӻ������� ��һ��ѹǿ�½�AsH3��NH3��PH3�Ļ�����彵��������Һ������
��5�����Ķ��ֻ������Ϊ���Բ��ϣ�������������һ�֣�ij�������ľ����ṹ��ͼ2��ʾ�������Ļ�ѧʽΪ ���辧���߳�Ϊacm�������ӵ�����ΪNA���þ�����ܶ�Ϊ g��cm��3���ú�a��NA��ʽ�ӱ�ʾ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com