
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极 | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 外电路电子流入的一极为正极,电子流出的一极为负极 |
 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1Fe(NO3)2溶液:Mg2+、H+、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$、Na+ | |
| C. | Na2O2溶于水产生O2:2O22-+2H2O═O2↑+4OH- | |
| D. | 用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
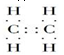 ,B的结构简式
,B的结构简式 或
或 .
. ,
, 、
、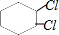 、
、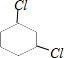 、
、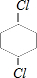 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
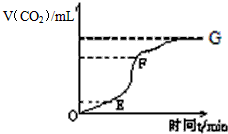 (Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:| 时间(s) 物质的量浓度(mol/L) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的戊烷所含的分子0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4+
NH4+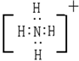
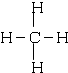 ; CO2O=C=O
; CO2O=C=O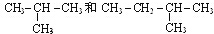 I.
I.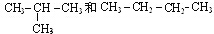
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的电子式 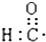 | B. | 丙烷的分子结构的比例模型: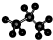 | ||
| C. | 乙烯的最简式(实验式):CH2 | D. | 硝基苯的结构简式: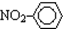 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com