
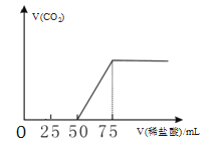
【题目】2019年9月起,澳大利亚山火已经持续100多天,产生了大量温室气体。有50mLNaOH溶液,向其中逐渐通入一定量的CO2,然后向溶液中逐滴加入0.1mol/L的稀盐酸,产生的CO2气体体积(标准状况)与所加入的盐酸的体积之间的关系如图所示。下列说法正确的是
A.滴加盐酸过程中,混合溶液的导电能力不断增强
B.滴加盐酸过程中,混合溶液中c(CO32-)、c(HCO3-)、c(H2CO3)之和不断减小
C.V(稀盐酸)=25mL时,c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
D.V(稀盐酸)=50mL时,c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
【答案】B
【解析】
由图可知,加入50mL盐酸之前,反应无气体生成,且再加入25mL即反应到达终点,即通入一定量二氧化碳后,溶液为等物质的量的氢氧化钠和碳酸钠的混合溶液,实验分为三个阶段:第一阶段,滴入的25mL盐酸和氢氧化钠反应;第二阶段,继续滴入的25mL盐酸与碳酸钠反应生成碳酸氢钠;第三阶段,滴入的25mL盐酸与碳酸氢钠反应生成二氧化碳。
A. 滴加盐酸过程中,第一阶段,盐酸与NaOH反应生成NaCl,离子总数不变,但溶液体积增大,所以离子浓度降低,导电性减弱;第三阶段,盐酸与碳酸氢钠反应产生二氧化碳,混合溶液中离子浓度也下降,导电能力不断减弱,A错误;
B. 滴加盐酸过程中,由于溶液体积变大,所以根据物料守恒可知,溶液中c(CO32-)+c(HCO3-)+c(H2CO3)不断减小,在第三阶段,随着盐酸加入,二氧化碳逸出,使c(CO32-)、c(HCO3-)、c(H2CO3)之和更小,B正确;
C. V(稀盐酸)=25mL时,盐酸恰好消耗完氢氧化钠,为等物质的量的碳酸钠和氯化钠混合溶液,溶液中CO32-是大量的,而H+和H2CO3是少量的,所以c(H+)+c(H2CO3) <c(CO32-) + c(OH-),C错误;
D. V(稀盐酸)=50mL时,溶液为碳酸氢钠和氯化钠混合溶液,根据物料守恒可知,c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)+c(Cl-),D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对比类推法是一种常用的学习和研究方法。下列离子方程式的书写正确且类推合理的是
选项 | 离子方程式 | 类推 |
A | 家庭漂白原理:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
B | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | 向FeI2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
C | 用石墨电极电解NaCl饱和溶液:2H2O+2Cl- | 用石墨电极电解AlCl3饱和溶液:2H2O+2Cl- |
D | 明矾净水:Al3++3H2O | 硫酸铁净水:Fe3++3H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素原子序数依次喊小,原子半径的大小关系为:r(Y)>r(X)>r(Z), 三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )

A. X元素位于ⅥA族 B. A难溶于B中
C. A和C不可能发生氧化还原反应 D. B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被誉为21世纪的“终极能源”,具有高效、高压、环保、体积小等特点,氢能转化被视为新能源汽车终极解决方案,也是资本与技术趋之若鹜的领域。镧镍合金LaNix是一种良好的储氢材料。工业上可用下列方法冶炼镍。
![]()
(1)一个电子的运动状态取决于________种因素,基态Ni原子核外电子占据_____个不同原子轨道。
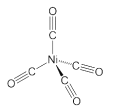
(2)CO分子内σ键和π键个数之比为________;已知Ni(CO)4的结构如图所示,中心原子Ni的杂化类型为_________,Ni原子参与形成了______个配位键,Ni(CO)4属于______晶体,理由是________________________________。
(3)研究发现镧镍合金LaNix属六方晶系,其晶胞如图a中实线或图a所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。

①LaNix合金中x的值为_______;
②晶胞中和“![]() ”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______________g/cm-3(保留2位有效数字,NA=6.0×1023![]() =1.7)。
=1.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
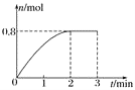
A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积固定为3 L的某密闭容器中加入1 mol A、2 mol B,一定温度下发生如下反应:A(s)+2B(g)![]() C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是
C(g)+D(g),经反应5 min后,测得C的浓度为0.3 mol·L-1。则下列说法中正确的是
A. 5 min内D的平均反应速率为0.02 mol·L-1·min-1
B. 5 min内A的平均反应速率为0.06 mol·L-1·min-1
C. 经5 min后,向容器内再加入C,正反应速率变小
D. 平衡状态时,生成1 mol D时同时生成1 mol A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种用于治疗疟疾的药物,挽救了全球特别是发展中国家数百万人的生命,它的分子式为C15H22O5。NA表示阿伏伽德罗常数,下列关于青蒿素的说法不正确的是( )
A.青蒿素的摩尔质量等于282![]() B.14.1g青蒿素中含氧原子数目为0.05NA
B.14.1g青蒿素中含氧原子数目为0.05NA
C.1mol青蒿素完全燃烧,生成11NA个H2OD.10g青蒿素中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com