
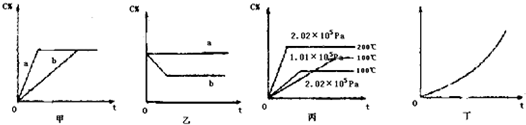
A、 | B、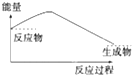 | C、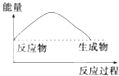 | D、 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
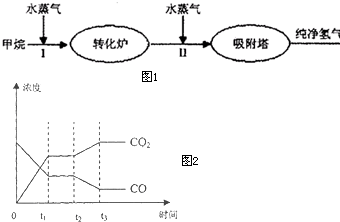 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图1:| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
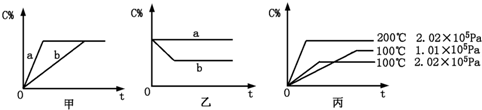
查看答案和解析>>
科目:高中化学 来源: 题型:
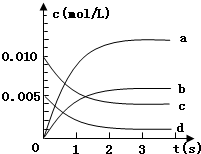 800℃时,在2L密闭容器内,发生反应:2NO(g)+O2(g)?2NO2(g),已知在此体系中,n(NO)随时间的变化如表:
800℃时,在2L密闭容器内,发生反应:2NO(g)+O2(g)?2NO2(g),已知在此体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
| c2(NO2) |
| c2(NO)×c(O2) |
| c2(NO2) |
| c2(NO)×c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
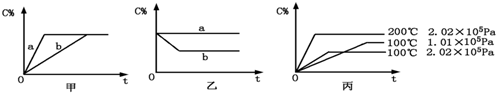
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com