
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3 | (1)在白色浑浊物中加入过量盐酸,会变澄清 |
假设2 | (2)白色浑浊物是BaSO4,主要 原因是Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 | 反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊; (3)通入纯净的CO2的目的防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 |
分析 (1)BaSO3可溶于盐酸或稀硫酸,注意在此不可用硝酸;
(2)生成BaSO4一定发生了氧化还原反应,要考虑到可能的氧化剂;
(3)空气中的氧气也有一定的氧化性,会对三价铁氧化二氧化硫造成干扰;
(4)三价铁能氧化二氧化硫,硫酸根和钡离子反应产生沉淀.
解答 解:(1)亚硫酸钡是能溶于盐酸的白色沉淀,硝酸能将其氧化为硫酸钡白色沉淀,所以可以在白色浑浊物中加入过量盐酸,看是否变澄清,
故答案为:在白色浑浊物中加入过量盐酸,会变澄清;
(2)Fe3+氧化了水中的SO2,产生硫酸根离子,在Ba2+作用下,生成BaSO4沉淀,故答案为:Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4;
(3))空气中的氧气也有一定的氧化性,防止制备的SO2气体中混有空气(O2),这时对说明Fe3+氧化SO2造成干扰,所以二氧化碳一定要纯净,
故答案为:防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰;
(4)二氧化硫先和三价铁之间发生氧化还原反应,即 SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,然后生成的硫酸根离子再和钡离子之间反应,即Ba2++SO42-=BaSO4↓,
故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+、Ba2++SO42-=BaSO4↓.
点评 本题主要考查了二氧化硫的性质,综合性较强,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) | |
| B. | 在常温下,10 mL 0.2 molL-1盐酸与10 mL 0.2 molL-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13 | |
| C. | 在0.1 molL-1 NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-) | |
| D. | 5 mL 1 molL-1 CH3COONa溶液与5 mL 1 molL-1盐酸混合液中c(Cl-)=c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
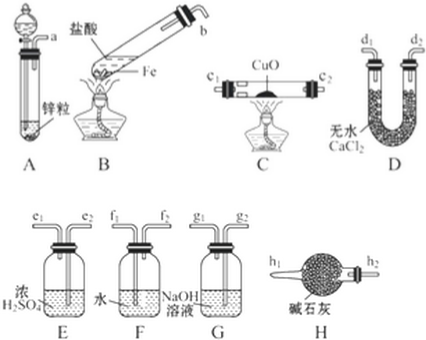
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol OH-中含有9NA个电子 | |
| B. | 28 g CO气体中含有NA个氧原子 | |
| C. | 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第2周期元素的第一电离能随原子序数递增依次增大 | |
| B. | 氟元素的电负性最大 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | CH2═CH2分子中共有四个σ键和一个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.50 mol Ba(OH)2 | B. | 100 mL水 | C. | 0.50molC2H5OH | D. | 0.50molNa2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 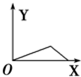 | B. | 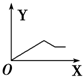 | C. | 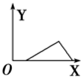 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com