
【题目】已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入浓NaF溶液后,Mg(OH)2不可能转化成为MgF2
【答案】B
【解析】
A. 25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液中,c(Mg2+)=![]() ,由于Ksp[Mg(OH)2]<Ksp(MgF2),则饱和MgF2溶液中c(Mg2+)大,A错误;
,由于Ksp[Mg(OH)2]<Ksp(MgF2),则饱和MgF2溶液中c(Mg2+)大,A错误;
B. 25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,铵根离子结合溶液中的氢氧根离子,使氢氧根离子浓度减小,Mg(OH)2向电离的方向移动,溶液中的c(Mg2+)增大,B正确;
C. Ksp[Mg(OH)2]只与温度有关,温度未变,则Ksp不变,C错误;
D. 25°C时,Ksp[Mg(OH)2]与Ksp(MgF2)接近,则Mg(OH)2与MgF2可以相互转化,D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】为防治含硫煤燃烧产生的大气污染,某工厂设计了新的治污方法,工艺流程如图所示。下列叙述错误的是( )
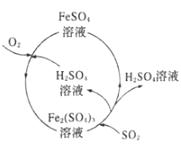
A.该流程可以除去煤燃烧时产生尾气中的SO2,变废为宝
B.该流程中H2SO4和Fe2(SO4)3溶液可以循环利用
C.流程中每吸收11.2LSO2(标准状况)同时产生1molFe2+
D.流程中涉及的Fe2+被氧化的反应的离子方程式为4Fe2++O2+2H2O═4Fe3++4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
A. X为0.2 mol·L-1
B. Y为0.1 mol·L-1
C. Z为0.3 mol·L-1
D. Z为0.1 mol·L-1时,Y为0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:

(1)该反应的化学方程式是________________________。
(2)反应起始至t,Y的平均反应速率是__________________。
(3)X的转化率是_________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素 X、Y、Z、W 的相对位置如表,元素 X 的原子核外电子数是 Z的 2 倍。下列说法不正确的是

A. W 元素的简单气态氢化物的热稳定性比 Z 元素的简 单气态氢化物的高
B. 气体分子(ZW)2 的结构式为 N≡C—C≡N
C. X、Y、W 三种元素的简单离子半径最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其单质制备可用电解熔融 XCl2 的方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中存在广泛用途。

(1)如图是铁元素在元素周期表中的有关信息。
补全铁原子的核外电子排布式_____________3p63d64s2。“55.85”是________________________。自然界中存在的54Fe和56Fe,它们互称为_____________。
(2)将铁片放入冷浓硫酸中,片刻后将铁片移入硫酸铜溶液中,发现铁片表面无明显变化,原因是_____________。通常证明某溶液中含Fe2+的化学方法是_____________________。
(3)SO2 有强还原性,写出其与 FeCl3 溶液反应的离子方程式______________________。
若有 0.4mol FeCl3 发生反应,则需要标准状况下的 SO2______________升。
(4)发黄的深井水通常含 Fe3+,若向水中加入 Na2CO3 溶液,则产生红褐色沉淀和无色无味的气体。请从平衡移动角度解释这一现象___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了下图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
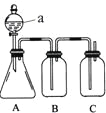
(1)仪器a的名称:________。
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为________。
(3)装置B所盛试剂是____________________,其作用是_____________。
(4)装置C所盛试剂是_______________,
C中反应的离子方程式是________________。
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()

A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com