
已知:还原性强弱:I— >Fe2+。往100 mL碘化亚铁
溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有1/2的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A.1.1mol·L-1 B.1.5mol·L-1 C.1.2mol·L-1 D.1.0mol·L-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某稀硫酸和硝酸的混合溶液200 mL,
分成两份。向其中一份逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO)。向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如下图所示。
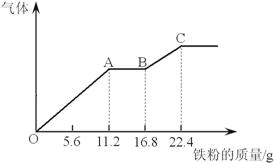
(1)第二份溶液中最终溶质为 ;
(2)OA段产生的气体是 (填化学式),BC段产生的气体是 (填化学式),AB段的反应为 ;
(3)原混合酸中HNO3的物质的量为 mol,H2SO4的物质的量浓度应为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
某Na2CO3、NaAlO2的混合溶液中逐滴
加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)
A.M点时生成的CO2为0 mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓

查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+ 和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应方程式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠
浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是 ( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。
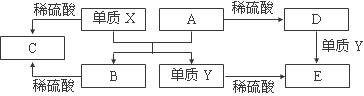
|
A.X与A反应的化学方程式是:Al2O3 + 2Fe ==== Fe2O3 + 2Al
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在一固定容积的密闭容器中发生反应:2NO2(g)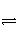
 N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
A.不变 B.增大
C.减小 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com