
【题目】下列有关甲烷及其氯代物说法正确的是
A.甲烷及其氯代物中都只存在极性键B.甲烷及其氯代物都是正四面体结构
C.甲烷性质稳定,但可以被酸性高锰酸钾溶液氧化D.甲烷与氯气发生取代反应时,共生成四种物质
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置或操作进行相应实验,能达到实验目的的是( )
A. 用图所示装置制取少量纯净的CO2气体
B. 如图所示,用CCl4提取溴水中的Br2
C. 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
D. 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两个铂电极插入500mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
A. 4×10-3mol/L B. 2×10-3mol/L C. 1×10-3mol/L D. 1×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述和判断正确的是
A. H3O+离子的空间构型是平面三角形
B. NH![]() 的中心原子的杂化轨道类型是sp3杂化,离子呈三角锥形结构
的中心原子的杂化轨道类型是sp3杂化,离子呈三角锥形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D. C2H4分子中的碳原子以sp2杂化,其中C=C键是由两个碳原子的sp2-sp2轨道形成一个σ键和p-p轨道形成一个π键构成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aL NH3完全溶于1L水得到VmL氨水,溶液的密度为ρg/cm3(ρ<1),溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
①![]() ②
②![]() ③
③![]() ④
④![]()
⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.50ω
A. ①②④ B. ②③④ C. ②④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.增加反应物的用量一定能增大反应速率
B.化学反应速率只能加快不能减慢
C.决定化学反应速率的主要因素是浓度
D.参加反应物质的性质是决定化学反应速率的主要因素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种Cu- Li可充电电池的工作原理如图所示,其中非水系电解液和水系电解液被锂离子固体电解质陶瓷片( LISICON)隔开。下列说法正确的是
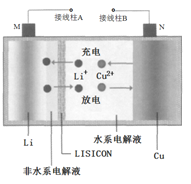
A. 陶瓷片允许水分子通过
B. 电池放电时,N极上发生氧化反应
C. 电池充电时,接线柱B应与外接直流电源的负极相连
D. 电池充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同;
②标准状况下,11.2 LH2和14gN2所含原子数相同;
③28gCO 的体积约为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ⑤⑥ B. ②③⑤⑥ C. ②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识回答下列问题:
酸 | 电离常数 |
CH3COOH | K = 1.8×10 -5 |
H2CO3 | K1= 4.3×10 -7,K2= 5.6×10 -11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
(1)NaHSO3溶液中共存在7种微粒,它们是Na+、HSO3-、H+、SO32-、H2O、________、_________(填微粒符号)。
(2)常温下,物质的量浓度相同的下列溶液 :
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④ NH4HSO4
溶液中c(NH4+)最大的是:_________,最小的是:______(填序号)
(3)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为___________(填序号)
(4)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):_____________把AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是________(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com