
| A、煤燃烧是化学能转化为光能的过程 |
| B、1 mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| C、HCl 和 NaOH 反应的中和热△H=-57.3 kJ/mol,则H2SO4和 Ca(OH)2 反应的中和热△H=2×(-57.3)kJ?mol-1 |
| D、反应 H2(g)+F2(g)═2HF(g);△H=-270 kJ?mol-1说明在相同条件下,1 mol 氢气与 1 mol 氟气的能量总和大于2 mol 氟化氢气体的能量 |


科目:高中化学 来源: 题型:
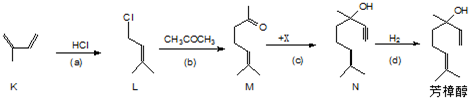

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.00 mol?L-1 NaCl溶液中含有Na+的数目为NA |
| B、常温常压下,6.4g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA |
| C、标准状况下,1.12LHCHO中C原子的数目为0.05NA |
| D、一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、结构相似,分子组成相差一个或若干个CH2原子团的有机物是同系物 |
| B、常压下,正戊烷、异戊烷、新戊烷的沸点依次降低 |
| C、乙烯、聚氯乙烯和苯分子中均含有碳碳双键 |
| D、丙烯的结构简式为CH3CH﹦CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH |
| B、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| C、向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O |
| D、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 400℃ |
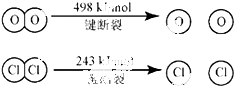
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是
(1)将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com