
(12分)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:
2X(g)
 Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为 。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5mol/(L・min);乙v(Y)=2mol/(L・min);丙v(Z)=4.5mol/(L・min);丁v(X)=0.075mol/(L・s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 (填"左"或"右"或"不")移动;若向
达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不")移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的
平衡中的X的转化率相比较 。
A.无法确定 B.⑷一定大于⑴ C.⑷一定等于⑴ D.⑷一定小于⑴
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,则a、b、c应该满足的关系为 。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为 。
(共12分)(1)0.03mol/(L・min) (2)丁 乙 甲 丙 (以上各2分)
(3)不 、右 (各1分) (4)D (5)c=3b a≥0 (6)0.9<c≤4.5 (以上各2分)
【解析】
试题分析:(1) 2X(g) 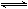 Y(g)+3Z(g)
Y(g)+3Z(g)
起始量(mol) 3 0 0
转化量(mol) 2x x 3x
平衡量(mol)3-2x x 3x
平衡时测得容器内的压强为起始时的1.2倍
则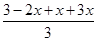 =1.2
=1.2
解得x=0.3mol
所以平衡时Y的物质的量浓度=0.3mol÷2L=0.15mol/L
因此Y的物质的量浓度变化表示的速率为0.15mol/L÷5min=0.03 mol/(L・min)
(2)在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5mol/(L・min);乙v(Y)=2mol/(L・min);丙v(Z)=4.5mol/(L・min);丁v(X)=0.075mol/(L・s),则根据反应速率之比是相应的化学计量数之比可知,如果都用X表示反应速率,则分别是3.5mol/(L・min)、4mol/(L・min)、3.0mol/(L・min)、4.5mol/(L・min)。温度越高反应速率越大,所以根据反应速率可知,温度由高到低的顺序是(填序号) 丁>乙>甲>丙。
(3)若向达到(1)的平衡体系中充入氩气,由于其它物质的浓度不变,则平衡不移动;若向达到(1)的平衡体系中移走部分混合气体,导致生成物浓度降低,则平衡向右移动。
(4)由于该反应是体积增大的可逆反应,且反应物只有一种,所以平衡后再次通入X气体,相当于增大压强,平衡向逆反应方向移动,所以若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的平衡中的X的转化率相比较⑷一定小于⑴,答案选D。
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,则根据方程式将生成物Y和Z恰好可以完全转化为X即可,所以a、b、c应该满足的关系为c=3b且a≥0。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达到平衡时仍
与(1)的平衡等效,则根据方程式将生成物Y和Z恰好可以完全转化为X,使X的物质的量等于3mol即可,所以c的最大值是4.5mol。由于平衡时c的物质的量是0.9mol,所以要满足起始时维持化学反应向逆反应方向进行,则c必须大于0.9mol,因此c的取值范围是0.9<c≤4.5。
考点:考查可逆反应的有关判断、计算;外界条件对平衡状态的影响;等效平衡的应用与计算等


科目:高中化学 来源: 题型:
【12分】向100 mL 3 mol·L-1硫酸铝铵溶液中逐滴加入1 mol·L-1 Ba(OH)2溶液。
(1)写出刚好出现沉淀的总物质的量为最大值时的离子方程式(用一个式子表示):__________。
(2)随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。
写出B点和C点对应的Ba(OH)2溶液体积:B. _______________,C._______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)>c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖南株洲市南方中学高二上学期期末考试理科化学试卷(带解析) 题型:填空题
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖南株洲市高二上学期期末考试理科化学试卷(解析版) 题型:填空题
(12 分)(每空2分)CH3COOH是中学化学中常用的一元弱酸,请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol·L-1的CH3COOH溶液与50mL 0.2mol·L-1的NaOH溶液混合,所得溶液呈 性,原因 (用离子方程式表示)。
(3)已知某混合溶液中只含有CH3COO-、H+、Na+、OH-四种离子,且离子浓度大小关系为:c(CH3COO-)> c(H+)> c(Na+)> c(OH-),则该溶液中含有的溶质为 。
(4)已知Ka(CH3COOH)= 1.76×10-5 ,Ka(HNO2)= 4.6×10-4,若用同浓度的NaOH溶液分别中和等体积且pH相等的CH3COOH和HNO2,则消耗NaOH溶液的体积关系为:
前者 后者(填“>,<或=”)
(5)已知25℃时,0.1mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠呈碱性,所以溶液的pH增大;乙同学给出另外一种不同于甲同学的解释,请你写出乙同学可能的理由
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com