
| A、同系物可能互为同分异构体 |
| B、甲烷化学性质比较稳定,不能被任何氧化剂氧化 |
| C、甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应 |
| D、C4H10分子中四个碳原子在一条直线上 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Na、Mg、Al最外电子层电子数依次增多 |
| B、P、S、Cl最高正价依次升高 |
| C、Li、Na、K金属性依次增强 |
| D、N、O、F最高正价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验目的 | |
| ① | 分别测定0.01mol/L的HCl和H2S的c(H+) | 比较氯和硫的非金属性强弱 |
| ② | 混合气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | 除去CO2中少量的SO2 |
| ③ | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
| ④ | 将硫酸铜晶体分别放入浓硫酸和稀硫酸中 | 鉴别浓硫酸和稀硫酸 |
| A、②④ | B、①③ | C、①② | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属与盐溶液间的反应一定是置换反应 | ||||
| B、能与酸反应的氧化物一定是碱性氧化物 | ||||
C、
| ||||
| D、常见金属铁和铝在工业上是由热还原法制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在ABn分子中A原子的所有价电子都参与成键 |
| B、在ABn分子中A的相对原子质量应小于B的相对原子质量 |
| C、在ABn分子中每个共价键的键长都相等 |
| D、分子中不能含有H原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
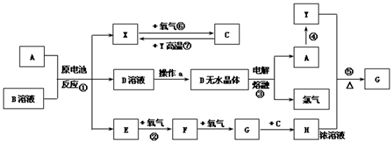
查看答案和解析>>
科目:高中化学 来源: 题型:
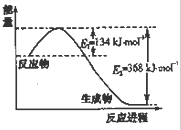
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com