
【题目】抗结肠炎药物有效成分M的合成路线如下(部分反应略去试剂和条件):
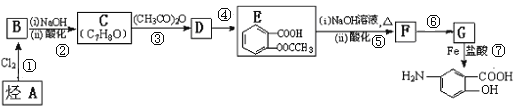
已知:①![]()
②![]()
(1)烃A的名称是______________,G中的官能团名称是_______________。
(2)反应①的反应条件是__________,反应④的反应类型是______________。
(3)E与足量NaOH溶液反应的化学方程式是______________。
(4)符合下列条件的D的同分异构体有___________种。其中核磁共振氢谱有4组峰且峰面积之比为6:2:1:1的结构简式是______________。
①属于芳香族化合物且苯环上有3个取代基
②能和NaHCO3溶液反应产生气体
(5)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物![]() 的合成路线______________。
的合成路线______________。
【答案】
(1)甲苯;羧基、羟基、硝基
(2)Fe(或氯化铁);氧化反应
(3)![]()
(4)6;![]() (或
(或![]() )
)
(5)![]()
【解析】
试题分析:C发生信息(a)中的反应生成D,D发生氧化反应生成E,结合C的分子式与E的结构简式,可知C的结构简式为![]() ,则D为
,则D为![]() ,D用酸性高锰酸钾溶液氧化得到E.烃A与氯气在FeCl3催化剂条件下反应得到B,B发生水解反应、酸化得到C,则A为
,D用酸性高锰酸钾溶液氧化得到E.烃A与氯气在FeCl3催化剂条件下反应得到B,B发生水解反应、酸化得到C,则A为![]() ,B为
,B为![]() .E与氢氧化钠反应、酸化得到F为
.E与氢氧化钠反应、酸化得到F为![]() ,由信息(b)并结合抗结肠炎药物有效成分的结构可知,F在浓硫酸、浓硝酸加热条件下发生反应生成G为
,由信息(b)并结合抗结肠炎药物有效成分的结构可知,F在浓硫酸、浓硝酸加热条件下发生反应生成G为![]() ,G发生还原反应得到抗结肠炎药物有效成分。
,G发生还原反应得到抗结肠炎药物有效成分。
(1)由上述分析可知,烃A的结构简式是![]() ,名称叫甲苯,G为
,名称叫甲苯,G为![]() ,含有的官能团有羧基、羟基、硝基,故答案为:甲苯;羧基、羟基、硝基;
,含有的官能团有羧基、羟基、硝基,故答案为:甲苯;羧基、羟基、硝基;
(2)①的反应条件是FeCl3作催化剂,④的反应类型是氧化反应,故答案为:FeCl3作催化剂;氧化反应;
(3)E与足量NaOH溶液反应的化学方程式是:![]() ,故答案为:
,故答案为:![]() ;
;
(4)D为![]() 。①属于芳香族化合物且苯环上有3个取代基,②能和NaHCO3溶液反应产生气体,说明结构中含有羧基,符合条件的D的同分异构体有:骨架为
。①属于芳香族化合物且苯环上有3个取代基,②能和NaHCO3溶液反应产生气体,说明结构中含有羧基,符合条件的D的同分异构体有:骨架为![]() 有2种;骨架为
有2种;骨架为 有3种;骨架为
有3种;骨架为![]() 有1种,共6种;其中核磁共振氢谱有4组峰且峰面积之比为6:2:1:1的结构简式是
有1种,共6种;其中核磁共振氢谱有4组峰且峰面积之比为6:2:1:1的结构简式是![]() (或
(或![]() ),故答案为:6;
),故答案为:6;![]() (或
(或![]() )
)
(5)甲苯和浓硝酸发生取代反应生成邻甲基硝基苯,邻甲基硝基苯和酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸,其合成路线为![]() ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从毒韭菜到炸鸡翅、从速溶茶到儿童奶粉,关于食品质量的报道中不断有①“致癌农药”、②“苏丹红”、③“碘元素”、④“亚硝酸盐”、⑤“三聚氰胺”等化学名词出现。业内人士告诉记者,化学性污染正成为危急食品安全的一大“杀手”。上述化学名词所提到的物质中,在某食品添加剂中允许含有但符合限量时不会引起中毒的是( )
A.②③④ B.②③ C.③④ D.只有③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①2H2(g)+O2(g)=2H2O(l)ΔH1=-571.6kJmol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0kJmol-1
③CO(g)+2H2(g)![]() CH3OH(g)ΔH3=-90.8kJmol-1
CH3OH(g)ΔH3=-90.8kJmol-1
计算甲醇蒸气的燃烧热ΔH= 。
(2)对于可逆反应C(S)+H2O(g)![]() CO(g)+H2(g),平衡常数表达式为 ,能判断该反应一定达到化学平衡状态的依据是 。(填选项编号)
CO(g)+H2(g),平衡常数表达式为 ,能判断该反应一定达到化学平衡状态的依据是 。(填选项编号)
A.容器中气体的平均相对分子质量不随时间而变化
B.v正(H2O)=v逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总质量不随时间而变化
E.消耗n mol H2的同时消耗n mol CO
(3)某化学兴趣小组探究外界条件对合成甲醇反应的影响。
CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJmol-1
CH3OH(g)△H=-91kJmol-1
①在300℃时,向体积为1L的密闭容器中加入2mol H2和1mol CO,CO和CH3OH(g)的浓度随时间变化如图所示。
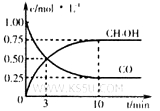
则从反应开始到建立平衡,v(H2)为 ;
②在其它条件不变时,只改变其中的一个条件,该小组同学根据实验绘制如下图像,其中与事实相符的是 。(填序号)
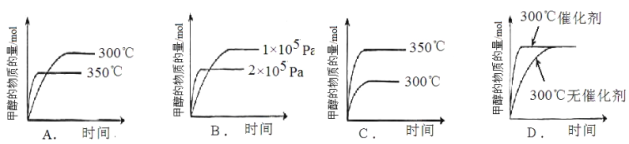
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.3gNa,Na2O,Na2O2的混合物与足量水反应,在标准状况下得到672ml混合气体将该混合气体通过放电恰好反应,则原混合物中Na、Na2O、Na2O2的物质的量之比
A.1:2:1 B.1:1:1 C.1:3:1 D.4:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列生活中常见物质的俗名与化学式相对应的是
A. 苏打—NaHCO3 B. 酒精—CH3OH C. 铁红—FeO D. 生石灰—CaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氯化氢气体溶解在1L水中(水的密度近似为lg/mL),所得溶液的密度为 ρ g/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.ω= 36.5c/(1000ρ) B.ρ= (36.5V+22400)/(22.4V+22.4)
C.ω = 36.5V/(36.5V +22400) D.c = 1000Vρ/(36.5V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大。A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族。回答下列问题:
(1)A、B、C的第一电离能由大到小的顺序为_______________(用元素符号表示)。
(2)B与C形成的二元化合物中,属于非极性分子的是________(填化学式),该分子中心原子的杂化轨道类型为_____________。
(3)A、C分别形成的常见的含氧酸分子中,中心原子的价层电子对数为4的酸是______(填化学式,下同),酸根呈平面三角形的酸是________________。
(4)Dn+、Br-、C的最高价含氧酸跟、A的简单氢化物按1:1:1:5形成某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物中的配体为___________,n值为__________,Dn+的基态电子排布式为____________。
(5)立方EB晶体的结构如图所示,其晶胞边长为apm,列式表示EB晶体的密度为__________g·cm-3(不必计算出结果,阿伏伽德罗常数的值为NA)。人工制备的EB晶体中常存在缺陷:一个E2+空缺,另有两个E2+被两个E3+所取代,其结果晶体仍呈电中性,但化合物中E和B的比值却发生了变化。已知某化合物样品组成E0.96B,该晶体中E3+与E2+的离子个数之比为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们获得食盐的方式有多种,最主要的是海水晒盐。通过海水晾晒得到的粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验流程(试剂以化学式表示)
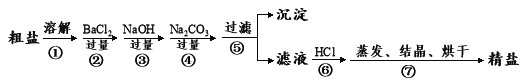
(1)BaCl2、NaOH、Na2CO3的加入顺序,必须保证___________在____________后
(2)溶解、过滤、蒸发过程中都使用到的玻璃仪器是_______ _________,蒸发时玻璃棒的作用是______________________
(3)经过⑤步骤之后得到的沉淀的成分为:________________________
(4)制得的精盐中不小心混入了硝酸钾晶体,用电子天平称取8.00g样品溶于水,向溶液中加入足量硝酸银溶液,将产生的沉淀过滤、洗涤、干燥,并称得其质量为14.35g,则该样品中氯化钠的质量分数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com