
孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实验室以孔雀石为原料制备CuSO2·5H2O晶体的流程图:
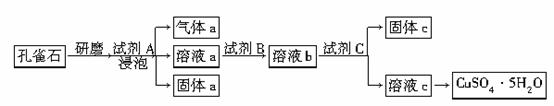
(1)研磨孔雀石的目的是____________________________________________________________。
浸泡孔雀石的试剂A若选用过量的稀硫酸,则固体a是________(填化学式)。
(2)试剂B的目的是将溶液中的Fe2+转化为Fe3+,则试剂B宜选用________(填序号)。
A.酸性KMnO4溶液 B.双氧水
C.浓硝酸 D.CuO
相应的离子方程式为_____________________________________。
(3)试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离。则试剂C宜选用________(填序号)。
A.稀硫酸 B.NaOH溶液
C.氨水 D.CuO
固体c的化学式为_____________________________________。
(4)1 mol氨气通过加热的Cu2(OH)2CO3可以产生1.5 mol金属铜,则该反应的化学方程式为__________________________________________。
(5)常温下Fe(OH)3的Ksp=1×10-39,若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低1×10-3 mol/L必须将溶液调节至pH=________。
解析 (1)Cu2(OH)2CO3、铁的氧化物都能溶于稀硫酸,SiO2不与稀硫酸反应。(2)四种试剂都能将Fe2+氧化为Fe3+,但酸性KMnO4溶液反应后会生成 Mn2+引入杂质,浓硝酸反应后会引入NO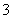 杂质,氯水反应后会引入Cl-杂质,只有H2O2反应后得到H2O无杂质离子产生,故选B。该反应中H2O2是氧化剂,H2O是还原产物,Fe2+是还原剂,Fe3+是氧化产物,由得失电子守恒知n(Fe2+)∶n(H2O2)=2∶1,最后再根据电荷守恒和质量守恒得2Fe2++2H++H2O2===2Fe3++2H2O。(3)调节溶液的pH使Fe3+转化为Fe(OH)3沉淀但又不能引入新的杂质,可考虑CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3等能与H+反应的含铜化合物。(4)设反应后N元素化合价为x,由得失电子守恒可知1.5×2=x-(-3),解得x=0,所以得到的氧化产物是N2,再由得失电子守恒配平:3Cu2(OH)2CO3+4NH3
杂质,氯水反应后会引入Cl-杂质,只有H2O2反应后得到H2O无杂质离子产生,故选B。该反应中H2O2是氧化剂,H2O是还原产物,Fe2+是还原剂,Fe3+是氧化产物,由得失电子守恒知n(Fe2+)∶n(H2O2)=2∶1,最后再根据电荷守恒和质量守恒得2Fe2++2H++H2O2===2Fe3++2H2O。(3)调节溶液的pH使Fe3+转化为Fe(OH)3沉淀但又不能引入新的杂质,可考虑CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3等能与H+反应的含铜化合物。(4)设反应后N元素化合价为x,由得失电子守恒可知1.5×2=x-(-3),解得x=0,所以得到的氧化产物是N2,再由得失电子守恒配平:3Cu2(OH)2CO3+4NH3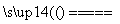 6Cu+3CO2+9H2O+2N2。(5)由Ksp=c(Fe3+)·c3(OH-)可得:c(OH-)=
6Cu+3CO2+9H2O+2N2。(5)由Ksp=c(Fe3+)·c3(OH-)可得:c(OH-)= mol·L-1=10-12 mol·L-1,c(H+)=10-2 mol·L-1,pH=2。
mol·L-1=10-12 mol·L-1,c(H+)=10-2 mol·L-1,pH=2。
答案 (1)增大固体表面积,以增大反应速率,同时增大浸出率 SiO2 (2)B 2Fe2++2H++H2O2===2Fe3++2H2O (3)D Fe(OH)3 (4)3Cu2(OH)2CO3+4NH3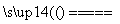 6Cu+3CO2+9H2O+2N2 (5)2
6Cu+3CO2+9H2O+2N2 (5)2


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
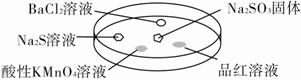
下表中对实验现象的描述或所做的解释不正确的是( )。
| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料,物质间的转化关系如图所示。下列说法正确的是(双选)( )。
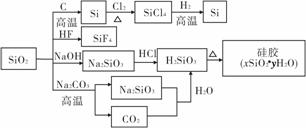
A.SiO2既能与HF反应, 又能与NaOH反应,属于两性氧化物
B.SiO2是光导纤维材料,Si是半导体材料
C.在硅胶中加入CoCl2可显示硅胶是否吸水失效
D.图中所示转化反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
咖啡酸是一种在医学上具有较广泛的应用的医药中间体和原料药。
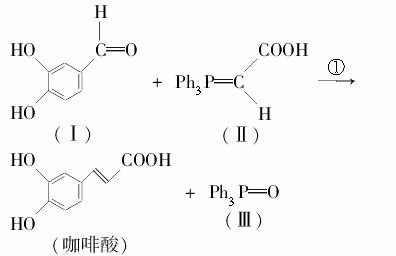
咖啡酸苯乙酯是一种天然抗癌药物,由苯乙烯合成咖啡酸苯乙酯的过程之一是:

(1)化合物Ⅰ的分子式为________;反应③的反应类型为________反应。
(2)若化合物Ⅱ和Ⅲ中的“Ph”为苯基、“P”为磷原子,则化合物Ⅱ的结构简式为________________;咖啡酸苯乙酯的键线式结构简式为________________。
(3)足量的溴水与咖啡酸发生反应的化学方程式为__________________________________________
__________________________________________。
(4)下列说法错误的是________。
A.化合物Ⅰ能发生银镜反应
B.苯乙烯发生加聚反应生成热固性塑料
C.苯乙醇能使酸性高锰酸钾溶液褪色
D.镍催化下,1 mol咖啡酸最多可加成4 mol H2

查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于催化剂的说法,正确的是( )
A.催化剂能使不起反应的物质发生反应
B.催化剂在化学反应前后,化学性质和质量都不变
C.催化剂不能改变化学反应速率
D.任何化学反应,都需要催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加碳的量③通入CO2④恒容下充入N2⑤恒压下充入N2
能够使反应速率增大的措施是( )
A.①④ B.②③⑤ C.①③ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。

(1)酸浸时反应的化学方程式为________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)加CaCO3调节溶液的pH至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6- 2x。滤渣Ⅱ的主要成分为________(填化学式);若溶液的pH偏高,将会导致溶液中铝元素的含量降低, 其原因是______________(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是__________________;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com