
(13分)综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
A.可在酸性氧化物中寻找 B.可在碱性氧化物中寻找
C.可在ⅠA、ⅡA族元素形成的氧化物中寻找 D.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A: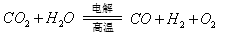 已知:
已知:
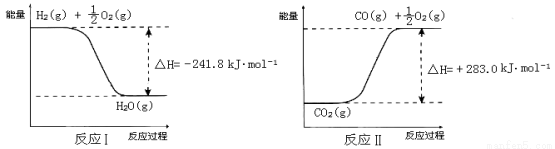
① 反应Ⅱ是_____反应(填“吸热”或“放热”)。
② 反应A的热化学方程式是 。
(4)如图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3  Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
Na2S4+3NaBr 闭合开关K时,b极附近先变红色。则
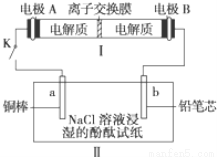
①负极反应式为:
②当有0.02 mol Na+通过离子交换膜时,b电极上析出的气体体积为 mL
③闭合K后,b电极附近的pH (填变大、变小或不变);
同时a电极反应式为
1)B、C(1分);(2)CO2 + Li4SiO4 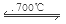 Li2CO3 + Li2SiO3(2分)
Li2CO3 + Li2SiO3(2分)
(3)① 吸热 (1分); ② CO2(g) + H2O(g) ==CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1(2分)
(4) ① 2Na2S2 – 2e- =2 Na+ + Na2S4 (2分)② 224ml(2分);③变大(1分),Cu – 2e- = Cu2+(2分)
【解析】
试题分析:由于CO2是酸性氧化物,所以如果要寻找吸收CO2的其他物质,应该在可在碱性氧化物中寻找或者可在ⅠA、ⅡA族元素形成的氧化物中寻找,故选项是B、C。(2)根据题意可得:CO2 + Li4SiO4 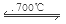 Li2CO3 + Li2SiO3;(3)由于生成物的能量高于反应物,所以发生的该反应是吸热反应;② 将反应Ⅱ的热化学方程式减去反应Ⅰ的热化学方程式,整理可得反应A的热化学方程式是CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g) ΔH=+524.8KJ/mol;(4)闭合开关K时,b极附近先变红色。则在b电极上溶液中的H+放电,附近的水电离溶液显碱性,所以b是阴极,a是阳极。则电源电极A是正极,B是负极。①在负极B上Na2S2失去电子,发生氧化反应,电极反应式为:2Na2S2 – 2e- =2 Na+ + Na2S4 ;②当有0.02 mol Na+通过离子交换膜时,电子转移0.02mol,则在b电极上有0.02mol的H+放电产生氢气,析出的气体是0.01mol,体积为0.224L=224ml. ③闭合K后,由于在阴极b电极H+放电,破坏了附近的水的电离平衡,水会继续电离,直至建立新的平衡,最终由于附近c(OH-)>c(H+),所以碱性增强,附近的pH增大;同时阳极a电极材料是Cu,是活性电极,电极本身失去电子,发生氧化反应,电极反应式为Cu – 2e- = Cu2+。
Li2CO3 + Li2SiO3;(3)由于生成物的能量高于反应物,所以发生的该反应是吸热反应;② 将反应Ⅱ的热化学方程式减去反应Ⅰ的热化学方程式,整理可得反应A的热化学方程式是CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g) ΔH=+524.8KJ/mol;(4)闭合开关K时,b极附近先变红色。则在b电极上溶液中的H+放电,附近的水电离溶液显碱性,所以b是阴极,a是阳极。则电源电极A是正极,B是负极。①在负极B上Na2S2失去电子,发生氧化反应,电极反应式为:2Na2S2 – 2e- =2 Na+ + Na2S4 ;②当有0.02 mol Na+通过离子交换膜时,电子转移0.02mol,则在b电极上有0.02mol的H+放电产生氢气,析出的气体是0.01mol,体积为0.224L=224ml. ③闭合K后,由于在阴极b电极H+放电,破坏了附近的水的电离平衡,水会继续电离,直至建立新的平衡,最终由于附近c(OH-)>c(H+),所以碱性增强,附近的pH增大;同时阳极a电极材料是Cu,是活性电极,电极本身失去电子,发生氧化反应,电极反应式为Cu – 2e- = Cu2+。
考点:考查物质的性质及应用、热化学方程式的书写、原电池、电解池的电极判断、电极反应式的书写。


科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.则下列叙述中不正确的是( )
A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100mL
B.当金属全部溶解时收集到NO气体的体积一定为2.24L
C.参加反应的金属的总质量为9.6g>m>3.6g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
查看答案和解析>>
科目:高中化学 来源:2015届河北省石家庄市五校联考高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列离子方程式中不正确的是
A.FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.将氧气通入酸性碘化钾溶液中:2I-+O2+4H+=I2+2H2O
C.硫代硫酸钠溶液中加入稀硫酸:2H++S2O32-=S↓+SO2↑+H2O
D.酸性高锰酸钾溶液中加入草酸:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三10月月考理综化学试卷(解析版) 题型:实验题
(15分)银氨溶液可用于检测CO气体,实验室研究的装置如图:
| 已知:银氨溶液制备反应为 Ag++2NH3·H2O=[Ag(NH3)2]++2H2O。 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用。 |
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的 (填“强氧化性”或“脱水性”)。
(2)装置A中软管的作用是 。
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10。
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体。
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象。
①实验c的目的是 。
②根据上述实验现象判断,上层清液中产物成分为 (填化学符号)。
(4)设计实验证明黑色固体的成分是Ag:
可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液。
取少量上述黑色固体,用蒸馏水洗净, ,说明黑色固体是Ag单质。(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①写出生成AgCl沉淀的离子反应 。
②若该反应中消耗6.6 g羟氨,理论上可得银的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三10月月考理综化学试卷(解析版) 题型:选择题
下列解释物质用途或现象的反应方程式不准确的是
A.硫酸型酸雨的形成会涉及反应:2H2SO3+O2 2H2SO4
2H2SO4
B.热的纯碱溶液可以清洗油污的原因:CO32— +2H2O H2CO3+2OH?
H2CO3+2OH?
C.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH?=SiO32—+H2O
D.成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ ClO-+2H+= Cl2↑+ H2O
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A.含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B.含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH) 2、K2CO3、BaCO3
D.含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法正确是( )
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO > NaClO4 D.酸性(水溶液):H2CO3 > HSCN > HCN
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是( )
A.若M(甲)>M(乙),则气体体积:甲<乙
B.若M(甲)<M(乙),则气体的压强:甲>乙
C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙
D.若M(甲)<M(乙),则的分子数:甲<乙
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高三第二次模拟考试化学试卷(解析版) 题型:选择题
以下示意图与相对应的反应情况分析正确的是

A.图1 :向含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2
B.图2 :向NaHSO4溶液中逐滴加入Ba(OH)2溶液
C.图3 :向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D.图4 :向NaAlO2溶液中逐滴加入盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com