
| A. | 二氧化碳通入溶液后,先生成KHCO3 | |
| B. | 此白色固体可能为KOH 和K2CO3 | |
| C. | 原KOH溶液中物质的量浓度一定是0.500mol/L | |
| D. | 此白色固体可能有两种组成情况,这两种混合物都有含有K2CO3 |
分析 2.24L(标况下)CO2气体的物质的量为0.1mol,二氧化碳完全反应,若只发生:CO2+2KOH=K2CO3+H2O,则生成0.1mol的K2CO3,其质量=0.1mol×138g/mol=13.8g;
若只发生:CO2+KOH=KHCO3,则生成0.1mol的KHCO3,其质量=0.1mol×100g/mol=10g,由于13.8g>11.9g>10.0g,所以得到的白色固体是K2CO3和KHCO3的混合物,
设白色固体中K2CO3 x mol,KHCO3 y mol,根据C元素守恒及二者质量列方程计算,再根据钾离子守恒计算KOH物质的量,根据c=$\frac{n}{V}$计算KOH溶液物质的量浓度.
解答 解:2.24L(标况下)CO2气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
若只发生:CO2+2KOH=K2CO3+H2O,则生成0.1mol的K2CO3,其质量=0.1mol×138g/mol=13.8g,
若只发生:CO2+KOH=KHCO3,则生成0.1mol的KHCO3,其质量=0.1mol×100g/mol=10g,
由于13.8g>11.9g>10.0g,所以得到的白色固体是K2CO3和KHCO3的混合物;
设白色固体中K2CO3 x mol,KHCO3 y mol,
根据碳原子守恒,有:x mol+y mol=0.1 mol,
由二者质量可知:138g•mol-1×x mol+100 g•mol-1×y mol=11.9g
联立方程,解得x=0.05mol y=0.05mol
故白色固体中含有K2CO3 的质量=138g•mol-1×0.05 mol=6.9g,
原溶液中KOH物质的量为 2xmol+ymol=2×0.05mol+0.05mol=0.15mol,所用KOH溶液物质的量浓度为$\frac{0.15mol}{0.3L}$=0.500 mol•L-1,
A、二氧化碳通入溶液后,首先生成K2CO3,故A错误;
B、由于13.8g>11.9g>10.0g,所以得到的白色固体是K2CO3和KHCO3的混合物,故B错误;
C、由上分析可知,原KOH溶液中物质的量浓度一定是0.500mol/L,故C正确;
D、所以得到的白色固体是K2CO3和KHCO3的混合物,故D错误;
故选C.
点评 本题考查混合物的计算,题目难度中等,利用极限法判断产物的组成是解题关键.


科目:高中化学 来源: 题型:解答题
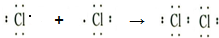 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O含电子数目为10NA | |
| B. | 标准状况下,NA个HF分子所占的何种约为22.4L | |
| C. | 4.5g SiO2晶体中含有的硅氧键的数目为0.3NA | |
| D. | 常温下将0.1mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L的NaHSO4溶液,PH=1 | B. | 0.1mol/L的H2SO4溶液,PH>1 | ||
| C. | 0.01mol/L的NaOH溶液,PH=10 | D. | pH=9的NaOH溶液稀释1000倍,PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2 | B. | KMgCl3 | C. | CaOCl2 | D. | Na3AlF6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| B. | 标准状况下,将1.12 L CO2气体通入1 L 0.1 mol/L的NaAlO2溶液中:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 由水电离出的c(H+)=1×10-12 mol/L 的溶液中可能大量存在K+、I-、Mg2+、NO3- | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═NH3•H2O+Al(OH)3↓+2BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将酸性高锰酸钾溶液滴入裂化汽油中,若紫红色褪去,证明其中含甲苯 | |
| B. | 让溴乙烷与NaOH醇溶液共热后产生的气体通入溴水,溴水褪色,说明有乙烯生成 | |
| C. | 向某卤代烃水解后的试管中加入AgNO3溶液,有淡黄色沉淀,证明它是溴代烃 | |
| D. | 往制备乙酸乙酯反应后的混合液中加入Na2CO3溶液,产生气泡,说明乙酸有剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取a g混合物用酒精灯充分加热后质量减少bg | |
| B. | 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收后质量增加bg | |
| C. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴甲基橙指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL | |
| D. | 取a g混合物于锥形瓶中加水溶解,滴入1~2滴酚酞指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温条件下稀释氢氟酸时,HF的Ka增大,水的KW不变 | |
| B. | 向Mg(OH)2沉淀悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大 | |
| C. | 0.1mol/LNaHCO3溶液中,c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com