
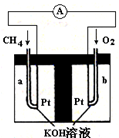
 燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”.
燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”.| 8.96L |
| 22.4L/mol |
| 0.4mol×4 |
| 8 |


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
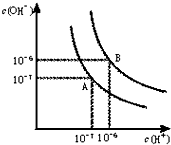 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:
| A、保持容器体积不变,加入水蒸气 |
| B、将容器的容积缩小一半 |
| C、保持容器容积不变,充入N2使体系压强增大 |
| D、保持压强不变,充入N2使体系容积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l) 2H2(g)+O2(g)=2H2O(g) | ||||
B、H2(g)+Cl2(g)=2HCl(g)
| ||||
C、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) NaOH(aq)+
| ||||
D、C(s)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
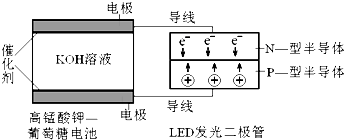
查看答案和解析>>
科目:高中化学 来源: 题型:
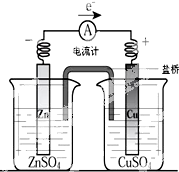 用铜片、锌片、CuSO4溶液、ZnSO4溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池.以下有关该原电池的叙述正确的是( )
用铜片、锌片、CuSO4溶液、ZnSO4溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池.以下有关该原电池的叙述正确的是( )| A、①② | B、②③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
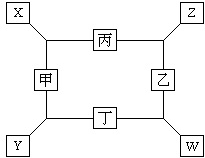 如图所示,已知:
如图所示,已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com