
分析 2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH=2NaAlO2+3H2↑,
(1)通过化学方程式可以看出,等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,金属是不足的,所以生成氢气的物质的量相等;
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,氢氧化钠和盐酸是不足的,通过化学方程式可以看出,1mol的盐酸会生成0.5mol的氢气,1mol的氢氧化钠会生成1.5mol的氢气;
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,通过化学方程式可以看出,生成1mol的氢气需要盐酸2mol,需要氢氧化钠$\frac{2}{3}$mol;
(4)盐酸和NaOH溶液中的溶质的物质的量均为:100×$\frac{1}{1000}$×3=0.3mol,
通过化学方程式可以看出,测得生成的气体体积比为V(甲):V(乙)=1:2,所以生成的氢气物质的量之比是1:2,
设铝与酸完全反应时,生成的氢气的物质的量为x
2Al+6HCl=2AlCl3+3H2↑
2 6 3
0.3mol x
$\frac{6}{0.3}=\frac{3}{x}$
解之得:x=0.15mol;
一定条件下气体的物质的量之比等于体积之比,所以氢氧化钠和铝反应生成的氢气的物质的量为:0.15mol×2=0.3mol,
碱与金属完全反应时,设碱与金属反应的物质的量为y
2Al+2NaOH=2NaAlO2+3H2↑
2 3
y 0.3mol
$\frac{2}{y}=\frac{3}{0.3}$
解之得:y=0.2mol
所以铝的质量为:0.2mol×27g/mol=5.4g.
解答 解:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH=2NaAlO2+3H2↑,
(1)通过化学方程式可以看出,等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,金属是不足的,所以生成氢气的物质的量相等,所得H2的体积之比是:1:1,故答案为:1:1;
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,氢氧化钠和盐酸是不足的,通过化学方程式可以看出,1mol的盐酸会生成0.5mol的氢气,1mol的氢氧化钠会生成1.5mol的氢气,所以产生H2的体积之比是1:3,故答案为:1:3;
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,通过化学方程式可以看出,生成1mol的氢气需要盐酸2mol,需要氢氧化钠$\frac{2}{3}$mol,所以HCl和NaOH的物质的量浓度之比是:3:1,故答案为:3:1;
(4)盐酸和NaOH溶液中的溶质的物质的量均为:100×$\frac{1}{1000}$×3=0.3mol,
通过化学方程式可以看出,测得生成的气体体积比为V(甲):V(乙)=1:2,所以生成的氢气物质的量之比是1:2,
设铝与酸完全反应时,生成的氢气的物质的量为x
2Al+6HCl=2AlCl3+3H2↑
2 6 3
0.3mol x
$\frac{6}{0.3}=\frac{3}{x}$
解之得:x=0.15mol;
一定条件下气体的物质的量之比等于体积之比,所以氢氧化钠和铝反应生成的氢气的物质的量为:0.15mol×2=0.3mol,
碱与金属完全反应时,设碱与金属反应的物质的量为y
2Al+2NaOH=2NaAlO2+3H2↑
2 3
y 0.3mol
$\frac{2}{y}=\frac{3}{0.3}$
解之得:y=0.2mol
所以铝的质量为:0.2mol×27g/mol=5.4g
故选:A.
点评 本题主要考查了氢氧化钠、盐酸和铝反应的化学方程式的计算,难度不大,需要认真分析题意即可解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
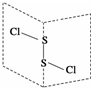 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔、沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应有SO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业冶铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 用生石灰制熟石灰CaO+H2O=Ca(OH)2 | |
| C. | 实验室制取二氧化碳CaCO3+2HCl=CaCl2+H2O+CO2↑ | |
| D. | 实验室制取氢气Zn+H2SO4=ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑦ | C. | ②⑤⑧ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若G的最高价氧化物水化物为强酸,则J一定是活泼非金属元素 | |
| B. | HnJOm为强酸,则G是位于VA族以后的活泼非金属元素 | |
| C. | 若T的最低化合价为-3,则G的最高正化合价为+6 | |
| D. | 若M的最高正化合价为+4,则五种元素不一定都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不随时间变化而变化 | |
| B. | 气体总物质的量不随时间变化而变化 | |
| C. | 2v正(B)=v逆(D) | |
| D. | 混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气 | |
| B. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 | |
| C. | 滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3. | |
| D. | 钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
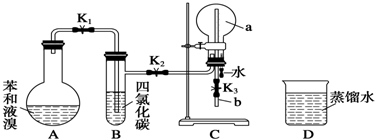
 ,能证明凯库勒观点错误的实验现象是C中产生“喷泉”现象.
,能证明凯库勒观点错误的实验现象是C中产生“喷泉”现象.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com