
【题目】在2L密闭容器内,80℃时反应:2NO(g)+O2(g)![]() 2NO2(g),反应体系中,n(NO)随时间t的变化如下表
2NO2(g),反应体系中,n(NO)随时间t的变化如下表
时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
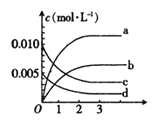
(1)如图表示NO2变化曲线的是________。(填字母)。用O2表示从0~2s内该反应的平均速率v=____________。
(2)能说明该反应已达到平衡状态的是___ _。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
e.等温等容时,充入氦气
f.等温等压时充入氦气
(4)若将2molNO和1molO2充入两个密闭容器中,保持一定温度进行反应:
2NO(g)+O2(g)![]() 2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
2NO2(g),在恒压条件下达到平衡时生成amolNO2,在恒容条件下达到平衡时生成bmolNO2,则a与b的关系是:a_______b(填“>”、”<“或”=”)
(5)如果按物质的量之比为2:1充入NO和O2的混合气体,则达到平衡时NO与O2的转化率 之比为_______。
【答案】(1)b;1.5×10-3 mol·L-1·s-1 (2)bc(3)c(4)>(5)1:1
【解析】
试题分析:(1)由方程式2NO(g)+O2(g)=2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,由表中数据可知,平衡时△c(NO)= (0.02×0.007)/2=0.00625mol/L, 曲线b平衡时的浓度为0.00625mol/L,故曲线b表示NO2的浓度变化,由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)= 0.006/2=0.003mol/(L.s),根据速率之比等于化学计量数之比,故v(O2)= 1/2 v(NO)= 1/2××0.003mol/(L.s)=0.0015mol/(L.s);
(2)A.未指明正逆速率,若都为同一方向速率,始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,A错误; B.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,B正确; C.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,v逆(NO)=2v正(O2),说明到达平衡,C正确; D.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,D错误;
(3)A.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故A错误; B.适当升高温度,反应速率增大,平衡向逆反应移动,故B错误; C.增大O2的浓度,反应速率增大,平衡向正反应移动,故C正确; D.选择高效的催化剂,增大反应速率,不影响平衡移动,故D错误;
(4)一定温度、恒压条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡,外压等于内压,生成amolNO2
2NO2(g)达到平衡,外压等于内压,生成amolNO2
如果一定温度、恒容条件下,这是一个反应前后气体的物质的量减少的反应反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡后,压强减少,相对第一个反应来说,相当于减压,平衡左移,生成bmolNO2的量减少;
2NO2(g)达到平衡后,压强减少,相对第一个反应来说,相当于减压,平衡左移,生成bmolNO2的量减少;
(5)如果是在等温等容的条件下,反应物的投料之比按照反应物前面的系数进行,则达到平衡时,反应物的转化率之比为1:1;


科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。
(1)肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图:
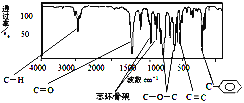
则肉桂酸甲酯的结构简式是_____________ (不考虑立体异构)。
(2)已知:I.醛与醛能发生反应,原理如下:
![]()
II.已知烃A在标准状况下的密度为1.25g·L-1。合成肉桂酸甲酯的工业流程如下图所示:
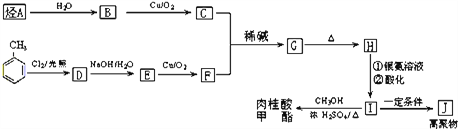
请回答:
①化合物J的结构简式为_______________;
②化合物G中的官能团有______________;
③G→H为_______________反应(填反应类型);
④写出反应D→E的化学方程式______________________;
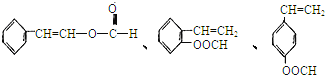
⑤符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:_____________
A.能发生水解反应 B.与银氨溶液作用出现光亮的银镜C.能与溴发生加成反应
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列说法中正确的是
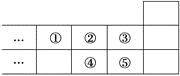
A. 元素①位于第2周期第ⅣA族
B. 气态氢化物的稳定性:④>②
C. 最高价氧化物对应水化物的酸性:⑤>④
D. 元素的最高正化合价:③=⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化。一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。下列判断正确的是

A. 原子半径 :Z<Y<X B. 非金属性 Z>Y>X
C. 化合物A易溶于水 D. 化合物B与C的混合物呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g) ![]() PCl5(g) ΔH<0。有关数据如下:
PCl5(g) ΔH<0。有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度/(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用.
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮.二者在反应过程中放出大量能量,同时生成无毒、无污染的气体.已知室温下,0.1mol燃料完全燃烧释放出的能量为255kJ,请写出该反应的热化学方程式__ ;
(2)298K时,在2L的密闭容器中,发生可逆反应2NO2(g)![]() N2O4(g)△H=-a kJmol-1 (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题.
N2O4(g)△H=-a kJmol-1 (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题.

① 298k时,该反应的平衡常数为___________;②若反应在398K进行,某时刻测得n(NO2)=0.6mol,n(N2O4)=1.2mol,则此时V(正)_ _V(逆)(填“>”、“<”或“=”).

③在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图3所示。下列说法正确的是___________
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B=C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d、e五个点,①水的电离程度最大的是___________,②其溶液中c(OH-)的数值最接近NH3H2O的电离常数K数值的是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com