
【题目】世界上最旱发现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载。回答下列问題:
(1)基态Zn原子的核外电子所占据的最高能层符号为_____________,Zn2+基态核外电子排布式为_______________________。
(2)硫酸锌溶于过量的氨水可形成[Zn(NH3)4]SO4溶液。
①[Zn(NH3)4]SO4中阴离子的空间构型为 _____________(用文字描述);
②SO42-中,中心原子的轨道杂化类型为______________;
③写出一种与SO42-互为等电子体的分子的化学式_____________;
④NH3极易溶于水,除因为它们都是极性分子外,还因为_______________________。
(3)Zn与S所形成化合物晶体的晶胞如图所示。
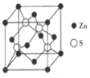
①该化合物的化学式为___________;
②已知该晶体的晶胞参数a=541 pm,其密度为___________g·cm-3(列出计算式即可)。
【答案】 N [Ar]3d10或1s22s22p63s23p63d10 正四面体 sp3 CCl4或SiCl4等 NH3 与 H2O之间可形成分子间氢键 NH3与H2O发生反应 ZnS 4×97 /NA×(541×1010)3
【解析】(1)根据Zn在周期表中的位置是第四周期,第IIB族,含有四个能层及核外电子排布式写法解答;
(2)在[Zn(NH3)4]SO4中,阴离子为SO42,根据价层电子对互斥模型和杂化轨道理论判断空间构型和杂化类型;根据等电子体的原理找出与SO42-互为等电子体粒子;NH3容易与水分子形成分子间氢键;
(3)①根据晶胞晶体中组成粒子的计算方法确定S2-、Zn2+的个数,进一步确定化学式;
②根据晶胞的密度计算公式进行计算。
(1)Zn的核电荷数是30,在Zn在周期表中的位置是第四周期,第IIB族,含有四个能层,分别是K、L、M、N,所以最高能层符号为N;Zn2+基态核外电子排布式为:[Ar]3d10或1s22s22p63s23p63d10;正确答案:N;[Ar]3d10或1s22s22p63s23p63d10;
(2)①根据价层电子对互斥模型, SO42中价电子对数为:(6+4×0+2)÷2=4,价电子对全是成键电子对,所以SO42的空间构型是正四面体,正确答案:正四面体;
②SO42的空间构型是正四面体,根据杂化轨道理论,中心原子S的杂化类型为sp3杂化,正确答案:sp3;
③等电子体是指在原子数相同下,原子的价电子数相同的粒子,通常采用元素上下左右平移法,同时调整电子数来确定等电子体粒子,因此,与SO42互为等电子体的有PO43, ClO4,CCl4 ,SiCl4, SiF4等,符合题干要求是分子的有CCl4 ,SiCl4, SiF4,正确答案为: CCl4 ,SiCl4, SiF4;
④NH3极易溶于水,除因为它们都是极性分子,NH3容易与水分子形成分子间氢键,同时还发生化学反应,其方程式为:NH3+H2O![]() NH3·H2O,正确答案:NH3 与 H2O之间可形成分子间氢键,NH3与H2O发生反应;
NH3·H2O,正确答案:NH3 与 H2O之间可形成分子间氢键,NH3与H2O发生反应;
(3)①对于立方晶胞,顶点粒子占1/8,面心粒子占1/2,晶胞内部原子为整个晶胞所有,则一个ZnS晶胞中,Zn2+个数为8×1/8+6×1/2=4,S2-个数为4,因此该化合物化学式为ZnS,正确答案为:ZnS;
②取1mol晶胞,则有NA个晶胞,已知晶胞参数为a=541pm,则一个晶胞的体积为V0=(541×1010)3cm3,1molZnS晶胞中,有4molZn2+和4molS2-,则一个晶胞的质量为m=4mol×65g/mol+4mol×32g/mol=4×97g,因此晶胞的密度为ρ=m/NAV0=4×97 g/[NA×(541×1010)3]cm3,所以正确答案:4×97 /[NA×(541×1010)3]g·cm-3。


科目:高中化学 来源: 题型:
【题目】下列关于氧化钠与过氧化钠的说法正确的是( )
A.它们属于碱性氧化物
B.它们都能与水反应产生氧气
C.它们都能与二氧化碳发生氧化还原反应
D.过氧化钠是潜水艇和呼吸面具的供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
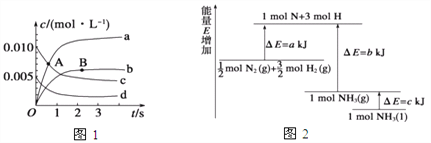
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)写出下列基团(或官能团)的名称或结构简式:-OH________ 、 碳碳双键__________、
(2)相对分子质量为72且沸点最低的烷烃的结构简式_______________;
(3)对下列物质进行系统命名:
![]() :__________;CH2=CHCH2CH3:_______________;
:__________;CH2=CHCH2CH3:_______________;
(4)分子式为C4H8O2的同分异构体中,属于酯类的有______种;
(5)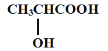 形成六元环酯的产物的结构简式__________________________。
形成六元环酯的产物的结构简式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (1)如图所示,若溶液C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为_________,A电极的电极反应式为____________;反应进行一段时间后溶液C的酸性会____(填“增强”“减弱”或“基本不变”)。

(2)我国首创以铝—空气—海水电池作为能源的新型海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是______(填化学名称),负极反应为___________;正极反应为_________。
(3)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,其负极反应式为2CO+2CO32---4e-![]() 4CO2,则正极反应式为_____,电池总反应式为______。
4CO2,则正极反应式为_____,电池总反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素且原子序数依次增大,元素Y和W同族。盐ZWX与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含ZWX的溶液。根据以上信息,试判断下列问题:
(1)写出这四种元素的元素符号:X_____、Y_____、Z____、W____,并将这四种元素的原子按照半径由大到小的顺序排列______(用具体的元素符号作答)
(2)Y的氢化物稳定性_________W的氢化物稳定性(填“大于”或“小于”),Y的氢化物水溶液酸性_________W的氢化物水溶液的酸性(填“大于”或“小于”)。
(3)写出Z2X2的电子式_____,该物质所含化学键的类型有_________。0.1 mol该物质与水反应转移电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为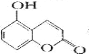 , ,下列有关说法正确的是
, ,下列有关说法正确的是
A.1 mol该物质与足量淮溴水反应,最多消耗2 molBr2
B.1mol该物质最多能与2mol NaOH反应
C.l mol该物质晟多能与3 mol H2加成
D.该物质的核磁共振氢谱共有6个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下: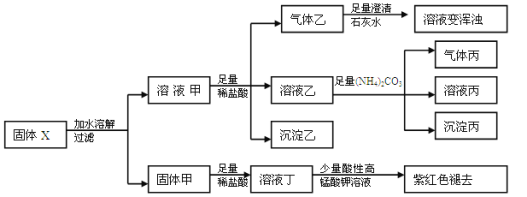
已知:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-下列说法正确的是( )
A. 气体乙和气体丙都为纯净物
B. 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 ,可能含有NaHCO3、Na2CO3
C. 溶液丁中的阳离子一定只含H+、Fe2+
D. 溶液甲中一定含有AlO2- ,可能含有CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com