
| 坩埚的质量 | 坩埚的质量+晶体质量 | 失水后坩埚的质量+固体质量 |
| 11.70g | 14.2g | 13.2g |
| A. | 晶体中含有不分解的杂质 | B. | 没有放在干燥器中冷却 | ||
| C. | 实验前,晶体表面吸附水 | D. | 没有进行恒重操作 |
分析 根据结晶水合物中,结晶水的质量=m(容器十晶体)-m(容器十无水硫酸铜),据化学方程式可以计算结晶水x的值,在测定中若被测样品中含有加热挥发的杂质或实验前容器中有水,都会造成测量结果偏高、偏低,结合x的理论值为5.0,进行分析解答.
解答 解:由表格中的数据,硫酸铜晶体的质量为:14.2g-11.70g=2.5g,水的质量:14.2g-13.2g=1g,
则CuSO 4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+xH2O,
160+18x 18x
2.5g 1g
解得:x≈5.93>5,说明测定结果偏大,
A.硫酸铜晶体中含不分解杂质,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,故A错误;
B.没有放在干燥器中冷却,导致水的质量偏小,测定结果偏小,故B错误;
C.实验前,晶体表面有吸附水,加热后水挥发,而造成加热前后固体的质量差偏大,使x值偏大,故C正确;
D.未做恒重操作,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,故D错误;
故选C.
点评 本题考查硫酸铜晶体中结晶水的测定,题目难度不大,把握实验操作时的注意事项,分析误差时从导致加热前后的质量差进行判断,试题培养了学生的化学实验能力.


 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
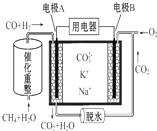
| A. | CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3 H2+CO,1 mol CH4参加反应转移12 mol电子 | |
| B. | 电极A为正极 | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | O2在B电极上被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向1ml 1mol/L的NaOH的溶液中滴加1~2滴2mol/LMgCl2溶液有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,出现红褐色沉淀,则证明Mg(OH)2的Ksp大于Fe(OH)3 | |
| B. | 由pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合后的溶液显酸性 | |
| C. | 由0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后的溶液显酸性 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7,则该溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
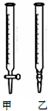 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,| 滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.98 |
| 3 | 25.00 | 0.20 | 20.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
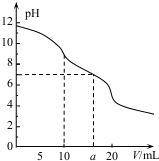 常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol•L HCl溶液滴定10.0mL浓度为0.1mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-) | |
| B. | 当V=5时:c(Na+ )>c(HCO3-)>c(CO32- )>c(Cl- ) | |
| C. | 当V=a时:c(Na +)>c(Cl- )>c(H+ )=c(OH- ) | |
| D. | 当V=10时:c(H+ )+c(H2CO3)=c(OH- )+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
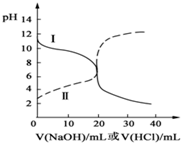 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )| A. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)═2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅰ:滴加溶液在10mL-20mL之间存在:c(Cl-)═c(NH4+)>c(OH-)═c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20mL时:c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
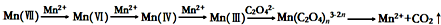
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
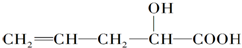 在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中-OH有关的可能反应为( )
在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中-OH有关的可能反应为( )| A. | ①②④⑤ | B. | ①②③⑤ | C. | ②③④⑤ | D. | ①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com