
【题目】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
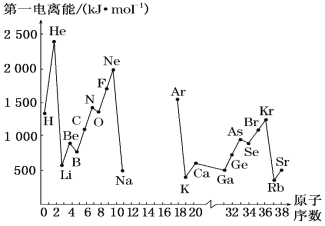
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____(填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N
Ⅰ.属于离子化合物的是_____;Ⅱ.属于共价化合物的是____;请设计一个实验方案证明上述所得到的结论____
【答案】Na Mg 第五周期ⅠA族 0.9~1.5 A BCD 测定各物质在熔融状态下能否导电,若导电则为离子化合物,反之则为共价化合物
【解析】
(1) ①根据曲线图,同一周期第一电离能随着原子序数的增大呈增大趋势,但第IIA族、第VA族反常,故Al的第一电离能的大小范围在Na、Mg两种元素之间;
②同一周期第一电离能随着原子序数的增大呈增大趋势,但第IIA族、第VA族反常;同主族从上到下第一电离能逐渐减小,故图中第一电离能最小的元素为Rb,Rb在周期表中的位置是第五周期ⅠA族;
(2)①根据曲线图,同周期电负性随原子序数的增大而增大,同主族从上到下电负性逐渐减小,故Mg元素电负性值的最小范围0.9~1.5;
②两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键;Li3N中N与Li电负性的差值为3.0-1.0=2.0>1.7,属于离子化合物;BeCl2中Cl与Be电负性的差值为3.0-1.5=1.5<1.7,属于共价化合物;AlCl3中Cl与Al电负性的差值为3.0-1.5=1.5<1.7,属于共价化合物;SiC中C与Si的电负性差值为2.5-1.8=0.7<1.7,属于共价化合物;要证明化合物是共价化合物还是离子化合物,只要证明该化合物在熔融状态下能否导电,若导电则为离子化合物,反之则为共价化合物。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】在不同条件下进行化学反应2A(g)=B(g)+D(g),B、D起始浓度均为0,反应物A的浓度(mol/L)随反应时间的变化情况如下表:
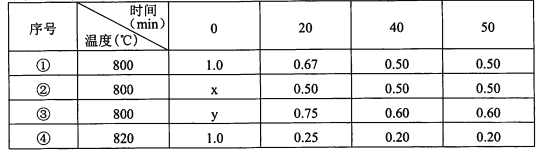
下列说法不正确的是
A.①中B在0~20 min平均反应速率为8.25xl0-3moI.L-l.min-l
B.②中K=0.25,可能使用了催化剂
C.③中y= 1.4 moI.L-l
D.比较①、④可知,该反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
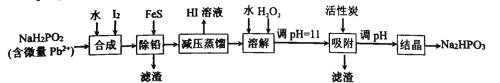
已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为______________
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为______________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为____(填化学式)。
(4)“调pH=11”的作用是______________。
(5)若“结晶”前溶液中Na2HPO3的浓度为0.1mol.L-1,则“吸附”处理后,应调节溶液pH至______________(填数值)。
(6)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
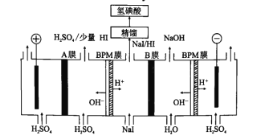
①B膜最佳应选择______________
②阳极的电极反应式是____。
③少量的I一因浓度差通过BPM膜,若撤去A膜,其缺点是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池具有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应为M1-XFeXPO4 + Li+ + e- = LiM1-XFeXPO4,其原理如图所示,下列说法正确的是( )
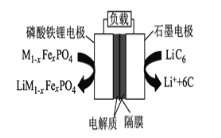
A.放电时电池的总反应为M1-XFeXPO4 + LiC6 =LiM1-XFeXPO4 + 6C
B.放电时,电流由石墨电极流向磷酸铁锂电极
C.充电时,Li+移向磷酸铁锂电极
D.充电时,石墨电极应该接到电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)2NH3(g)△H。有关键能数据如下:
化学键 | H-H | N-H | N≡N |
键能)kJ/mol) | 436 | 391 | 945 |
根据表中所列键能数据可得△H=____________。
(2)已知:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H= +49.0kJ/mol
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
已知水的气化热为44.0kJ/mol,表示氢气燃烧热的热化学方程式为______________。
(3)已知化学反应A(g)+B(g)C(g)+D(g),900℃时向一个体积为2L的密闭容器中充入0.20mol A和0.80mol B,2s时达到平衡,A的浓度变化0.05mol/L,则A的平均反应速率v(A) =________,平衡时B的转化率为____ ,C的体积百分数为_______ 。
(4)CO、H2可用于合成甲醇和甲醚,其反应为(m、n均大于![]() ):
):
反应①:CO(g)+2H2(g)CH3OH(g)△H=-m kJ/mol
反应②:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)△H=-n kJ/mol
反应③:2CH3OH(g)CH3OCH3(g)+H2O(g)△H<0
根据上述的热化学方程式可以判断则2m_____n(填“大于”、“小于”、“等于”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B.基态Fe原子的价电子轨道表示式:![]()
C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产生活中应用广泛。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的外围电子排布式___;基态铬、氮原子的核外未成对电子数之比为___。
(2)过硫酸铵[(NH4)2S2O8],广泛地用于蓄电池工业、石油开采、淀粉加工、油脂工业、照相工业等,过硫酸铵中N、S、O的第一电离能由大到小的顺序为___,过硫酸铵的阳离子的空间构型为___。
(3)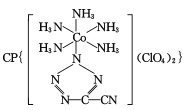 是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由
是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由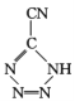 和[Co(NH3)5H2O](ClO4)3反应合成的,
和[Co(NH3)5H2O](ClO4)3反应合成的,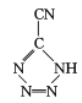 中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
中孤电子对与π键比值为__,CP的中心Co3+的配位数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com