
【题目】碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘的流程如图1和实验装置如图2: 
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③ , 步骤⑤ .
(2)写出步骤④对应反应的离子方程式:
(3)提取碘的过程中,可供选择的有机试剂是(填编号)
A.醋酸
B.苯
C.四氯化碳
D.酒精
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是 .
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图实验装置中存在的错误之处: .
【答案】
(1)过滤;萃取
(2)Cl2+2I﹣═I2+2Cl﹣
(3)BC
(4)普通漏斗、分液漏斗
(5)温度计水银球的位置不对
【解析】解:海藻在坩埚中灼烧得到海藻灰,将海藻灰浸泡得到海藻灰悬浊液,然后利用过滤的方法分离海藻灰悬浊液,得到残渣和溶液,在溶液中通入过量氯气,氯气和碘离子发生氧化还原反应得失I2 , 向含有I2的溶液中加入有机溶剂进行萃取,得到含有碘的有机溶液,再利用蒸馏的方法得到晶态碘,(1)分离不溶性固体和溶液采用过滤方法,分离碘水中的碘采用萃取的方法,所以③是过滤、⑤是萃取,所以答案是:过滤;萃取;(2)氯气具有强氧化性,能将碘离子氧化为碘,离子方程式为Cl2+2I﹣═I2+2Cl﹣ , 所以答案是:Cl2+2I﹣═I2+2Cl﹣;(3)萃取剂的选取标准:萃取剂和溶质不反应,萃取剂和原溶剂不互溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,A.醋酸和水互溶,所以不能作萃取剂,故错误; B.苯符合萃取剂的选取条件,所以可作萃取剂,故正确; C.四氯化碳符合萃取剂的选取条件,所以可作萃取剂,故正确; D.酒精和水互溶,所以不能作萃取剂,故错误;故选BC;(4)③缺少用于过滤的普通漏斗、⑤缺少用于萃取使用的分液漏斗,所以答案是:普通漏斗;分液漏斗; (5)蒸馏时,温度计测量馏分的温度,所以温度计水银球应该位于蒸馏烧瓶支管口处,所以答案是:温度计水银球的位置不对.


科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍.湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品.某化学小组模拟该方法回收铜和制取胆矾,流程简图如下: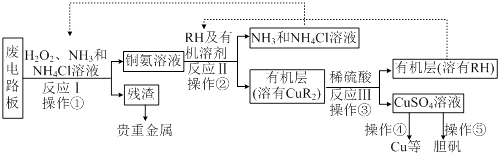
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)2+4,反应中H2O2 的作用是 .
(2)反应II是铜氨溶液中的Cu(NH3)2+4与有机物RH反应,写出该反应的离子方程式: . 操作②用到的主要仪器名称为 , 其目的是(填序号) .
a.富集铜元素 b.使铜元素与水溶液中的物质分离 c.增加Cu2+在水中的溶解度
(3)操作④以石墨作电极电解CuSO4 溶液.阴极析出铜,阳极产物是 . 操作⑤由硫酸铜溶液制胆矾的主要步骤是 .
(4)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种化合物W,X,Y,Z,它们都是由短周期元素A,B,C,D,E中的两种元素组成的.已知: (a)A,B,C,D,E五种元素的原子序数依次增大,且A,D同主族,C,E同主族,B、C同周期.
(b)W由B,C组成,分子中原子个数比为B:C=1:2,固体易升华.
(c)X由A,C组成,分子中原子个数比为A:C=1:1.
(d)Y由C,D形成的离子化合物,且Y中相应元素的微粒之比为:C:D=1:1.
(e)Z是由D,E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1:2.
试回答下列各小题:
(1)各元素符号:ABCDE
(2)W的电子式: .
(3)X的结构式: .
(4)Y的电子式: .
(5)Z的化学式: .
(6)写出Y与水反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据高中所学的化学反应原理解答下面的问题:
(1)下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0 kJmol﹣1
反应Ⅱ:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)△H=﹣173.6kJmol﹣1
写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)工业合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
温度/℃ | 250 | 350 |
K | 2.041 | x |
符合表中的平衡常数x的数值是(填字母序号).
A.0 B.0.012
C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) | c(H2) | c(CH3OH) | |
0min | 0.8molL﹣1 | 1.6molL﹣1 | 0 |
2min | 0.6molL﹣1 | y | 0.2molL﹣1 |
4min | 0.3molL﹣1 | 0.6molL﹣1 | 0.5molL﹣1 |
6min | 0.3molL﹣1 | 0.6molL﹣1 | 0.5molL﹣1 |
反应从2min到4min之间,H2的平均反应速率为 . 反应达到平衡时CO的转化率为 . 反应在第2min时改变了反应条件,改变的条件可能是(填字母序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.升高温度
(3)全钒液流储能电池(VRB)广泛应用于风能、太阳能发电系统的储能系统,电池反应为VO2++V2++2H+ ![]() VO2++V3++H2O,试推写出放电时正极的电极反应式 .
VO2++V3++H2O,试推写出放电时正极的电极反应式 .
(4)如图2为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况.据图分析:该温度下,溶度积常数的关系为:Ksp[Fe(OH)3] Ksp[Mg(OH)2](填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+ , 振荡后,白色沉淀会全部转化为红褐色沉淀,原因是 . 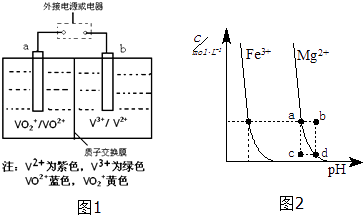
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列贮存化学试剂的方法正确的是( )
A.浓硝酸保存在棕色的广口瓶中,并放在阴凉处
B.少量的金属钠应保存在煤油中
C.烧碱溶液放在带玻璃塞的磨口试剂瓶中
D.用做感光材料的溴化银贮存在无色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将羧酸的碱金属盐溶液用惰性电极电解可得到烃类化合物,例如:2CH3COOK+2H2O ![]() CH3CH3↑+2CO2↑+H2↑+2KOH现有下列衍变关系(A、B、C、D、E、F、G均为有机物): 回答下列问题:
CH3CH3↑+2CO2↑+H2↑+2KOH现有下列衍变关系(A、B、C、D、E、F、G均为有机物): 回答下列问题:
(1)电解ClCH2COOK溶液时阳极的电极反应式是(填选项).
A.2ClCH2COO﹣﹣2e﹣=ClCH2CH2Cl+2CO2↑
B.2H++2e﹣=H2↑
C.2H2O+2e﹣=2OH﹣+H2↑
D.4OH﹣﹣4e﹣=2H2O+O2↑
(2)操作Ⅰ的名称是 , G的结构简式是 .
(3)写出B与银氨溶液按物质的量1:4反应的化学方程式: .
(4)写出下列化学方程式并指出其反应类型:A→B方程式: .
E→F方程式: .
指出反应类型:A→B , E→F .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W,R的化合价与原子序数的关系如图所示.下列说法正确的是( ) 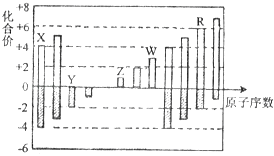
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:Y<R
C.Z和Y形成的化合物是离子化合物
D.常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com