
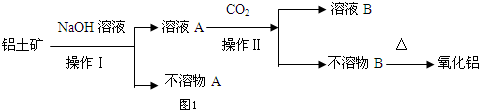
分析 铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2),加入氢氧化钠溶液,过滤得溶液A为偏铝酸钠溶液和硅酸钠溶液的混合物,沉淀A为氧化铁,溶液A中通入二氧化碳得不溶物B为氢氧化铝沉淀和溶液B为碳酸钠溶液,氢氧化铝受热分解得氧化铝,
(1)氧化铝、二氧化硅均可以和氢氧化钠发生反应,氧化铁和氢氧化钠之间不反应,据此来确定难溶物的成分;
(2)工业上电解熔融的氧化铝来获取金属铝,根据化学方程式结合电子转移计算生成金属铝的量;
(3)①根据每一步转化发生的反应确定所属的反应类型;
②碳酸钠可以和强碱氢氧化钙之间发生复分解反应;
(4)在涉及到食物包装及其含有铝元素的药品时要注意尽可能的避免.
解答 解:(1)氧化铝、二氧化硅均可以和氢氧化钠发生反应,氧化铁和氢氧化钠之间不反应,所以不溶物A的主要成分为Fe2O3,
故答案为:Fe2O3;
(2)工业上电解熔融的氧化铝来获取金属铝,即2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,根据化学方程式,电子转移为12mol生成金属铝是4mol,所以若电路中通过1mol电子,可以得到铝的质量是$\frac{4}{12}×27$=9g,
故答案为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;9;
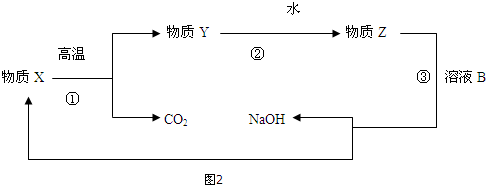
(3)①溶液B是碳酸钠,可以和氢氧化钙发生复分解反应生成碳酸钙和氢氧化钠,所以X是碳酸钙,Y是氧化钙,Z是氢氧化钙,涉及到了分解反应、化合反应以及复分解反应,不涉及置换反应,
故答案为:置换反应;
②流程中③的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,属于复分解反应,
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)在涉及到食物包装及其含有铝元素的药品时要注意尽可能的避免,如:不用铝制品作炊具,不用铝箔包装食品等,
故答案为:不用铝制品作炊具,不用铝箔包装食品等.
点评 本题考查学生铁以及化合物的性质、二氧化硅以及金属铝的化合物的性质知识,属于综合知识的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.001mol/(L•S) | B. | v(NH3)=0.002 mol/(L•S) | ||
| C. | v(H2O)=0.003 mol/(L•h) | D. | v(NO)=0.008 mol/(L•S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
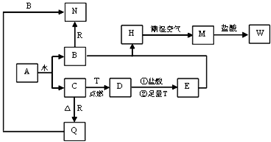 已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为14的碳原子的表达式:${\;}_{8}^{14}$C | |
| B. | 乙醇的结构简式:C2H5OH | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 甲烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 1:3:2 | C. | 2:3:1 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4 | B. | 饱和NaCl溶液 | C. | NaOH溶液 | D. | NaBr溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com