
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
分析 先算出铜和镁总共失去的电子数,而铜和镁失去的电子数,就是他们结合的氢氧根的物质的量,而结合氢氧根的质量就正好是质量增加的量,即为沉淀量.
解答 解:本题涉及反应有:Cu$\stackrel{失去2个电子}{→}$Cu2+$\stackrel{2OH-}{→}$Cu(OH)2,Mg$\stackrel{失去2e-}{→}$Mg2+$\stackrel{2OH-}{→}$Mg(OH)2,
反应后生成Cu(OH)2和Mg(OH)2,根据以上反应关系可知铜和镁失去电子数等于结合的氢氧根的物质的量,反应后沉淀的质量等于合金的质量加氢氧根离子的质量,
生成4480mL 的NO2气体和336mL的N2O4气体,反应中转移的电子的物质的量为:$\frac{4.48L}{22.4L/mol}$×(5-4)+$\frac{0.336L}{22.4L/mol}$×2×(5-4)=0.23mol,
所以生成的沉淀的质量为:4.7g+0.23mol×17g/mol=8.61g,
故选C.
点评 本题考查混合物的计算,题目难度中等,本题解答的关键是铜和镁失去的电子数,就是他们结合的氢氧根的物质的量,而结合氢氧根的质量就正好是质量增加的量.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16gCH4含有10NA个电子 | |
| B. | 0.1mol•L-1的盐酸溶液中含有0.1NA个H+ | |
| C. | 1molNa与乙醇完全反应,失去2NA个电子 | |
| D. | 标准状况下,22.4L苯含有NA个苯分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最后变为红褐色 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
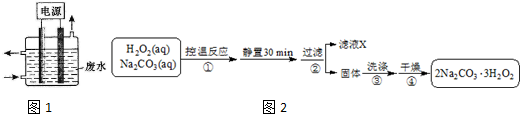
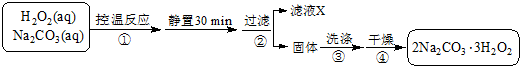
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:N>P>As>Sb>Bi | B. | 酸性:HNO3>H3PO4>H3AsO4>H3SbO4 | ||
| C. | 稳定性:NH3<PH3<AsH3<SbH3 | D. | 稳定性:HCl>H2S>PH3>SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
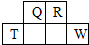 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题: .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成2n mol X,同时消耗nmol Y | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | 容器内气体的压强不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com