

 ,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是
,非金属性最强的元素是F,最高价氧化物的水化物碱性最强的碱的电子式是 ,最高价氧化物的水化物酸性最强的酸的化学式是HClO4;
,最高价氧化物的水化物酸性最强的酸的化学式是HClO4; .
. 分析 由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、F为氧、I为氟、G为Cl、H为Br、R为Ar.
(1)稀有气体Ar化学性质最不活泼;同周期自左而右非金属性增强、同主族自上而下非金属性减弱;上述元素中K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成;最高价氧化物的水化物酸性最强的酸为高氯酸;
(2)A、D元素的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(3)Na+、Al3+、O2-离子电子层结构相同,核电荷数越大离子半径越小;
(4)H元素跟A元素形成的化合物为NaBr,含有钠元素,焰色反应呈黄色;
(5)C和G两种元素形成化合物为MgCl2,由镁离子与氯离子构成,用电子式表示形成过程,左侧为原子电子式,右侧为相应物质的电子式,中间用→连接.
解答 解:由元素在周期表中位置,可知A为Na、B为钾、C为Mg、D为Al、E为碳、F为氧、I为氟、G为Cl、H为Br、R为Ar.
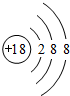
(1)稀有气体Ar化学性质最不活泼,其原子结构示意图为 ;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故上述元素中F元素非金属性最强;上述元素中K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成,电子式为
;同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故上述元素中F元素非金属性最强;上述元素中K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成,电子式为 ;最高价氧化物的水化物酸性最强的酸为HClO4;
;最高价氧化物的水化物酸性最强的酸为HClO4;
故答案为: ;F;
;F; ;HClO4;
;HClO4;
(2)A、D元素的最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)Na+、Al3+、O2-离子电子层结构相同,核电荷数越大离子半径越小,离子半径由大到小的顺序为O2->Na+>Al3+,故答案为:O2->Na+>Al3+;
(4)H元素跟A元素形成的化合物为NaBr,含有钠元素,焰色反应呈黄色,故答案为:黄;
(5)C和G两种元素形成化合物为MgCl2,由镁离子与氯离子构成,用电子式表示形成过程为 ,
,
故答案为: .
.
点评 本题考查元素周期表与元素周期律,难度不大,注意对元素周期律的理解掌握,注意用电子式表示物质或化学键的形成过程.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| W | X | Y | ||
| R | Z |
 .
.| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NO遇到空气变为红棕色 | |
| B. | NaCl溶液高温灼烧后呈现黄色 | |
| C. | SO2 通入到品红溶液中中使其褪色 | |
| D. | 含有色素的溶液加入活性炭后颜色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X为非气态,则正反应为放热反应 | |
| B. | 若正反应为放热反应,则X为气态 | |
| C. | 在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| D. | 压强变化对该平衡没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com