
| 样品起始质量-a点固体质量 |
| 样品起始质量 |
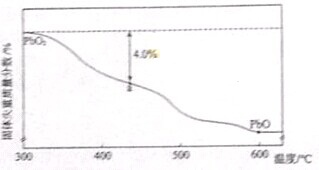
| ||
| 2-x |
| 2 |
| ||
| ||
| ||
| 2-x |
| 2 |
| 2-x |
| 2 |
| 2m+n |
| m+n |


科目:高中化学 来源: 题型:
| A、甲酸的性质与乙酸类似,都不能被酸性高锰酸钾溶液氧化 |
| B、石油和植物油都是混合物,且属于不同类的有机物 |
| C、乙醇转化为乙醛的反应有碳氧双键生成,属于消去反应 |
| D、纤维素、蔗糖、葡萄糖和淀粉酶在一定条件下都可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 3 |
2- 4 |
| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| 3 | 加入足量BaCl2溶液,反应后进行、干燥、称量,再向沉淀中加足量稀盐酸、然后干燥、称量 | 第一次称量读数为6.27g,第二次称量读数2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:
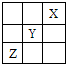 短周期元素X、Y、Z在周期表中的位置关系如图所示,下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,下列叙述中正确的是( )| A、Z的最高化合价为+6价 |
| B、X的最高价氧化物的水化物是一种强酸 |
| C、1molY的单质跟足量水反应时,发生转移的电子为1mol |
| D、Z一定是活泼金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
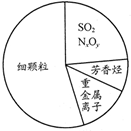 如图为雾霾的主要成分示意图.下列说法不正确的是( )
如图为雾霾的主要成分示意图.下列说法不正确的是( )| A、重金属离子可导致蛋白质变性 |
| B、苯是最简单的芳香烃 |
| C、SO2、NxOy都属于酸性氧化物 |
| D、利用丁达尔效应可检验雾霾是否为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B、Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C、Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D、CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com