
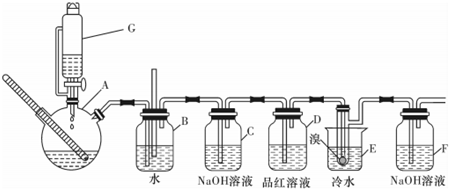
| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/(g/cm) | 0.79 | 2.2 | 0.71 |
| 沸点/ | 78.5 | 132 | 34.6 |
| 熔点/ | -130 | 9 | -116 |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
| 0.4681mol |
| 1.7173mol |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、液态氯化氢、固态氯化钠不导电,所以HCl、NaCl不是电解质 |
| B、NH3、CO2水溶液均能导电,所以NH3、CO2均是电解质 |
| C、蔗糖、酒精在水溶液中或熔化时不导电,所以它们不是电解质 |
| D、铜、石墨均导电,所以它们是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:NaHCO3>Na2CO3 |
| B、相同浓度溶液的碱性:Na2CO3<NaHCO3 |
| C、都能与酸反应放出CO2,但剧烈程度:NaHCO3>Na2CO3 |
| D、Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序 号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:把药品刮去糖衣,用研钵研碎;取少量研碎的粉末在试管中,用少量的蒸馏水溶解; | 硫酸亚铁在蒸馏水中溶解. |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
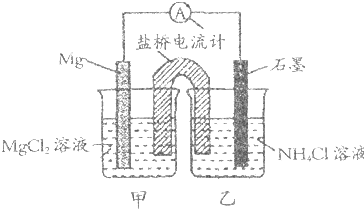
| A、石墨电极反应式为2NH4++2e-=2NH3↑+H2↑ |
| B、乙烧杯中一直存在:c(Cl-)<c(NH4+) |
| C、电子流向是由石墨→导线→Mg |
| D、盐桥中的Cl-移向乙烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当x=0.2,则混合溶液中y可能大于7或小于7 |
| B、当x=0.2,y=1,则混合溶液中:c(H+)=c(A2-)+c(OH-) |
| C、当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
| D、当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com