
| A. | K不变,平衡可能移动 | B. | 平衡移动,K值一定变化 | ||
| C. | 平衡移动,K值可能不变 | D. | K值变化,平衡一定移动 |
分析 平衡常数K是温度的函数,只与温度有关,温度一定,平衡常数K值一定,温度发生变化,平衡常数K值也发生变化.
解答 解:影响化学平衡的因素主要有浓度、温度、压强等.
A.K值只与温度有关,若在其他条件不变时,增大反应物的浓度或减小生成物的浓度,有利于正反应的进行,K值不变,平衡向右移动,故A正确;
B.若是改变浓度或压强使平衡发生移动,而温度不变,则K值不变,故B错误;
C.若在其他条件不变时,增大反应物的浓度或减小生成物的浓度,有利于正反应的进行,平衡向右移动,但K值只与温度有关,故K值不变,故C正确;
D.K值是温度的函数,K值变化,说明温度发生了改变,则平衡一定发生移动,故D正确;
故选B.
点评 本题考查平衡常数与平衡移动的关系,题目难度中等.要注意平衡常数K是温度的函数,只与温度有关.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
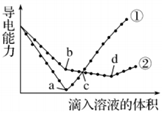
| A. | b点,水电离产生的c(H+)<10-7mol/L | B. | ①代表滴加H2SO4溶液的变化曲线 | ||
| C. | a、d两点对应的溶液均显中性 | D. | c点,两溶液中含有相同量的 OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙的化学式:CaClO2 | |
| B. | 作为相对原子质量标准的碳原子可表示为:126C | |
| C. | 钠原子的结构示意图: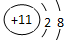 | |
| D. | 硫酸的电离方程式:H2SO4═H++SO42- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
0.1mol/L NH4Cl溶液中,下列叙述错误的是 ( )
A.c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.c(Cl—)>c(NH4+)>c(H+)>c(OH—)
C.c(NH4+)+c(H+)=c(Cl—)+c(OH—)
D.c(NH4+)+c(NH3 ·H2O)=c(Cl—)
·H2O)=c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
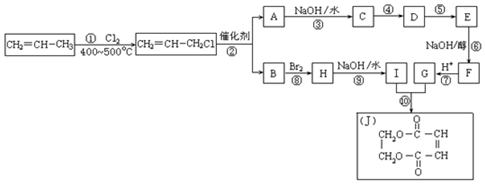
 两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.
两边基团换位的反应.如两个丙烯分子进行烯烃换位,生成丁烯和乙烯.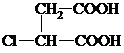 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室合成乙酸乙酯如(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是(78.5℃、118℃、77.1℃)
实验室合成乙酸乙酯如(如图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是(78.5℃、118℃、77.1℃)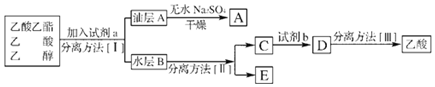
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
常温时0.05mol/L的Ba(OH)2溶液,pH为 ( )
A.12.7 B.12.0 C.13.0 D.13.7
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.加入铝粉能产生氢气的溶液:Mg2+、K+、Br-、HCO3-
B.滴入石蕊显红色的溶液:Na+、K+、S2-、NO3-
C.pH = 14的溶液中:Na+、AlO2-、SO42-、Cl-
D.滴入KSCN溶液显红色的溶液中:Ca2+、H+、I-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com