
| A、压强增大,平衡向逆反应方向移动 |
| B、Si02是氧化剂,CO是氧化产物 |
| C、上述反应若为放热反应,升高温度,平衡常数将减小 |
| D、上述反应中每生成1mol Si3N4,氮元素得12mol电子 |


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、H+、Cl- |
| B、K+、OH-、CO32- |
| C、CO32-、OH-、Cl- |
| D、K+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | SO2水溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | BaSO3难溶于盐酸 |
| B | Al放入浓HNO3中 | 无明显现象 | Al表面被浓HNO3氧化形成致密的氧化膜 |
| C | Na2SiO3溶液中通入CO2气体 | 产生白色胶状沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgSO4 |
| B、Ba(HCO3)2 |
| C、Mg(HCO3)2 |
| D、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、等物质的量的N2和CO所含分子数均为NA |
| D、常温常压下32g SO2与标准状况下11.2L N2含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | ||
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||
C、实验室用液溴和苯在催化剂作用下制溴苯: +Br2 +Br2
 +HBr +HBr | ||
| D、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X可能位于ⅠA族 |
| B、两元素形成的化合物中,原子个数比不可能是1:1 |
| C、X与Y的简单离子可能具有相同的电子层结构 |
| D、常温常压下,X2Y可能是气体、液体或固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
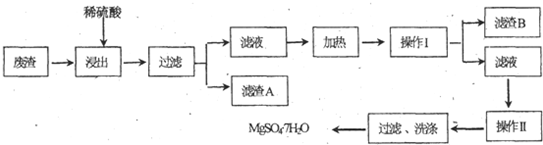

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com