
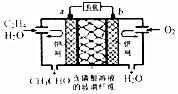
 中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该电池电极a为正极,b为负极 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 负极反应式为:CH2═CH2-2e-+H2O═CH3CHO+2H+ | |
| D. | b电极有2.24LO2反应,溶液中有0.4molH+迁移到b电极上反应 |
分析 由总反应式可知CH2=CH2被氧化,应为原电池的负极反应,因电解质溶液呈酸性,则负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,正极通入氧气,发生还原反应,电极方程式为O2+4H++4e-═2H2O,以此解答该题.
解答 解:A.由总反应式可知CH2=CH2被氧化,应为原电池的负极反应,所以a为负极,b为正极,故A错误;
B.电子只能经过导线,不能经过溶液,故B错误;
C.负极发生氧化反应,所以负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,故C正确;
D.由电极方程式O2+4H++4e-═2H2O可知,每有0.1mol O2反应,则向正极迁移H+0.4mol,但未指明标况,无法计算,故D错误;
故选C.
点评 本题考查了原电池原理的应用,为高频考点,注意掌握电极方程式的书写是解决本题的关键,易错点为B,注意电子不能流经溶液,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
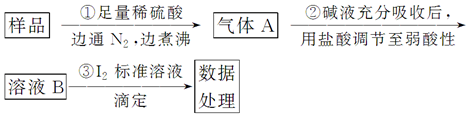
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
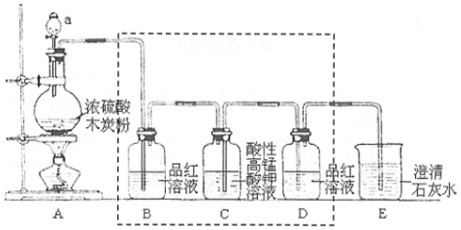
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
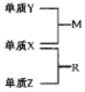 X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )
X、Y、Z是三种短周期元素,原子半径的大小为:K(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如图转化关系,其中 R为10电子分子,是一种常见的无机溶剂.下列说法中不正确的是( )| A. | X元素位于周期表中第16列 | |
| B. | X、Y、Z元素两两之间均能形成原子个数比为1:1的化合物 | |
| C. | X、Y、Z元素形成的单质均具有强还原性 | |
| D. | R的沸点高于M的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.
铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.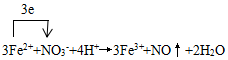 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

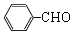 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2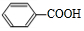 .
. +
+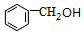 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$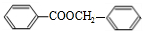 +H2O.
+H2O.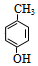 .
.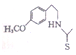 也能发生类似反应④的环化反应,VII的环化产物的结构简式
也能发生类似反应④的环化反应,VII的环化产物的结构简式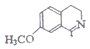 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com