
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
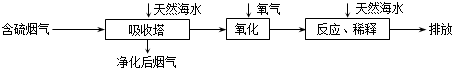
分析 (1)由无水氯化镁制取金属镁是电解熔融氯化镁生成氯气和镁;
(2)根据题目中所给难溶电解质的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更难溶;
(3)①强碱弱酸盐的水解反应是可逆反应;
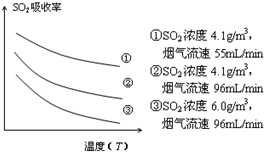
②根据图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,
③H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
解答 解:(1)由无水氯化镁制取金属镁的化学反应方程式 MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(2)题目中所给难溶电解质的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更难溶;所以用Na2S除去污水中的Cu2+和Pb2+效果更好,
故答案为:Na2S;
(3)①天然海水的pH≈8,是因为海水中有CO32-或HCO3-+它们水解使海水呈弱碱性,其离子方程式为CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-,故答案为:CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-;
②图示可知:SO2的吸收效率随着温度的升高而降低,随流速的增大而降低,所以要提高含硫烟气中SO2的吸收效率,可以降低含硫烟气温度(或流速),
故答案为:降低含硫烟气温度(或流速);
③H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染
故答案为:2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-;中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染.
点评 本题考查了方程式的书写,氧化还原反应,沉淀溶解平衡,盐类水解等,题目难度中等,但综合性较强.


科目:高中化学 来源: 题型:选择题

| A. | M能与FeCl3发生反应,不能与CH3COOH发生反应 | |
| B. | 1molM最多可消耗3mol NaOH | |
| C. | M与Br2只能发生取代反应,不能发生加成反应 | |
| D. | 1molM在催化剂作用下最多能与4mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
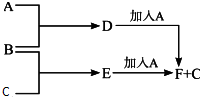 A、B、C为三种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E.它们之间的转化关系如图:
A、B、C为三种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E.它们之间的转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LCO含有的分子数为0.5NA | |
| B. | 标准状况下,22.4LSO3含有的分子数为NA | |
| C. | 常温常压下,8gO2含有的氧原子数为0.5NA | |
| D. | 同温同压下,11.2LCO和11.2LCO2含有的分子数均为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com