
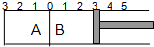
 如图所示,温度不变的某容器分隔成A、B两部分,A容器容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),
如图所示,温度不变的某容器分隔成A、B两部分,A容器容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),

科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
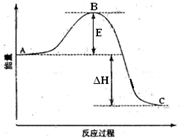
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| (m酸+m碱)?c?(t终-t始) |
| n |
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 盐酸溶液 | 氢氧化钠溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠固体(碳酸钠):加热固体混合物使之分解 |
| B、铁粉(铝):加入足量稀盐酸,充分反应后过滤、洗涤、干燥 |
| C、硫酸亚铁溶液(硫酸铁):加入足量铁屑,充分反应后过滤 |
| D、二氧化碳(氯化氢):依次通过盛有氢氧化钠溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④③ | B、④③②① |
| C、①④②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com